肠道菌群通过PUFA相关的神经炎症调节阿尔茨海默病的病理和认知障碍
Gut microbiota regulate Alzheimer’s disease pathologies and cognitive disorders via PUFA-associated neuroinflammation
肠道菌群通过PUFA相关的神经炎症调节阿尔茨海默病的病理和认知障碍
摘要译文
目的:本研究旨在研究肠道菌群失调在引发大脑炎症中的作用及其对阿尔茨海默病(AD)发病机制的贡献。
设计:我们生成了无菌3×Tg小鼠(AD转基因小鼠),并用来自AD患者和年龄匹配的健康供体的粪便样本对无菌3×Tg小鼠进行了再定植。以年龄依赖性的方式分析了3×Tg小鼠的肠道微生物群成。
结果:微生物16S核糖体RNA测序揭示了拟杆菌富集。我们发现,与无特异性病原体小鼠相比,无菌3×Tg小鼠中脑淀粉样蛋白β(Aβ)斑块和神经原纤维缠结(NFT)病理学显著减少。海马转录组测序技术(RNAseq)显示,在没有肠道微生物群的情况下,3×Tg小鼠大脑中的炎症途径和胰岛素/胰岛素样生长因子-1(IGF-1)信号传导会异常改变。通过代谢组学分析鉴定出多不饱和脂肪酸(PUFA)代谢产物,其氧化酶选择性升高,与小胶质细胞活化和炎症相对应。与健康供体的微生物群移植相比,AD患者的肠道微生物组加剧了3×Tg小鼠的AD病理学,与C/EBPβ/AEP(CCAAT增强子结合蛋白β/天冬酰胺内肽酶)途径激活和认知功能障碍相关。结论:这些发现支持行为缺陷,小胶质细胞活化和AD病理学需要复杂的肠道微生物组,肠道微生物组有助于AD小鼠模型中的病理学,并且人类微生物组的生态失调可能是AD的危险因素。
原文链接
https://gut.bmj.com/content/early/2022/01/10/gutjnl-2021-326269.long
Chen C, Liao J, Xia Y, et al. Gut. 2022 Jan 11;gutjnl-2021-326269
解读人:毕伟 副教授
主任医师,暨南大学附属第一医院神经内科行政副主任,帕金森及神经变性疾病专科主任,博士生导师,广东省杰出青年医学人才。
中国卒中学会血管性认识障碍分会常务委员、中国康复医学会帕金森病及运动障碍康复青年委员会分会副主任委员、广东省医学会神经病学分会青年委员会副主任委员、广东省中西医结合协会帕金森病及运动障碍委员会青年常委、广东省医学会神经病学分会帕金森及运动障碍学组委员。
Associate Editors of Journal of Alzheimer's Disease杂志编委。

研究解读
2021年11月埃默里大学亚特兰大医学院叶克强等教授在著名期刊Gut,发表了题为“Gut microbiota regulate Alzheimer’s disease pathologies and cognitive disorders via PUFA associated neuroinflammation”(肠道菌群通过PUFA相关的神经炎症调节阿尔茨海默病的病理和认知障碍)的研究。
阿尔茨海默病(AD)是一种进行性神经退行性疾病,慢性炎症在AD发病机制中起着关键作用,AD脑内的神经炎症由中枢刺激物,如老年斑和NFT所激活,以及包括内毒素在内的外周刺激物所激活。激活的小胶质细胞和神经炎症与AD患者的认知功能下降高度相关。此外,在宿主的整个生命周期中,肠道菌群是免疫和神经元反应中小胶质细胞功能的重要环境线索。肠-脑轴由免疫、迷走神经和神经内分泌途径组成,可调节宿主的认知行为。肠道菌群失衡可导致肠上皮屏障的通透性增加,同时释放促炎细胞因子并促进神经炎症反应。认知障碍和脑淀粉样变性患者的肠道菌群组成发生变化,与促炎细胞因子基因谱显著相关。
多不饱和脂肪酸(PUFAs)分为两类,α-亚麻酸(omega-3)和亚油酸(omega-6),是人体必需脂肪酸。它们与亚油酸的花生四烯酸(AA)和亚麻酸的二十碳六烯酸、二十碳五烯酸一起代谢为长链不饱和脂肪酸。当AA被激活的磷脂酶A2从细胞膜释放出来后,AA通过环氧合酶(COX-1,2)和5-脂氧合酶(5-LOX)分别代谢成前列腺素(PGs)和白三烯(LTs)。这些生物活性脂质是炎症的有效介体。AA代谢途径不仅是神经炎症的核心网络,也是导致工作记忆障碍导致AD发病的主要原因。
叶克强教授建立GF(无菌)和SPF(无特定病原体) 3×Tg AD小鼠模型,发现肠道微生物的存在可促进AD病理、认知缺陷和小胶质细胞的活化。并且与SPF相比,GF小鼠大脑中的C/EBPβ/AEP信号传导减弱,花生四烯酸(AA)代谢途径(炎症核心网络、记忆障碍导致AD发病)相关的Lox5、Cox1和Cox2水平明显降低(图1 AB),AEP酶活性降低(图1C),白介素-6(IL-6)浓度(C/EBPβ是其主要转录因子)也显著降低(图1D)。这些结果显示,GF 3×Tg小鼠表现出减弱的C/EBPβ/AEP通路和AA相关炎症,表明肠道菌群可促进AD小鼠模型的病理过程。接着研究表明,AD患者肠道微生物产丁酸盐的物种比例较低,而低比例的丁酸盐会导致促炎状态,且代谢组学的确发现人源AD患者粪便移植到GF小鼠的粪便和血清中短链脂肪酸(SCFA)减少,于是作者猜想SCFA是否会部分模拟定植SPF小鼠的肠道菌群并触发C/EBPβ/AEP通路激活?向GF 3×Tg AD小鼠连续补充SCFA混合物三个月,发现与对照GF小鼠相比,补充SCFA后小鼠C/EBPβ下游靶标水平(Lox-5、Cox1、Cox2、BLT1、BLT2)和AEP蛋白酶活性增强(图2AB),IL-6和Aβ42水平显著增加(图2CD)。行为学测试中补充SCFA后小鼠自发交替率显著受抑制(图2GH),表明认知缓解水平降低。然后作者对GF和SPF小鼠脑组织进行代谢组学分析,发现与SPF相比,GF小鼠粪便中的PUFA代谢物显著减少,同时补充SCFAs和PGE2-G(前列腺素E2的甘油结合代谢物)刺激小胶质细胞形态的成熟和活化(图2 J-L),PGE2-G单独治疗没有这一现象,说明PGE2只刺激成熟的小胶质细胞活化。以上结果表明,SCFA在GF 3×Tg小鼠中引发C/EBPβ/AEP激活和认知缺陷以及炎症,而AA代谢物PGE2-G加剧了炎症。前面的实验已经证明小鼠肠道微生物会影响AD病理,那么人源性肠道微生物移植到GF小鼠是否会影响疾病结果?于是作者用AD患者和健康人粪便在GF小鼠中建立人类肠道微生物群,结果发现AD受体小鼠同样激活了C/EBPβ/AEP通路,加剧炎症反应。
综上所述,AD肠道微生物群中缺乏产生抗炎丁酸盐的细菌,加上大脑中炎症性PGE2 代谢物升高,会增加小胶质细胞的活化,从而导致慢性神经炎症。这随后激活了C/EBPβ/AEP通路,从而提高淀粉样前体蛋白(APP)和tau表达水平并增强AEP δ-分泌酶活性,导致AD发病机制。这提示人类微生物组可能是AD的危险因素,通过个性化饮食、有益微生物群干预以及粪菌移植来调节肠道微生物群或可有助于减少炎症和治疗包括AD在内的脑部疾病。

(图据Gut)
图 1 无菌(GF)3×Tg小鼠表现出减弱的C EBPβ AEP通路和AA相关炎症。(A)免疫印迹显示p-C/EBPβ、C EBPβ、AEP、APP和tau的表达和加工,以及在无菌3×Tg小鼠和SPF 3×Tg小鼠脑中的花生四烯酸代谢。 (B)免疫印迹的定量分析。用imageJ测量活性AEP、TauN368、APPN585、C EBPβ、LOX5、Cox1、COX2、BLT1和BLT2的条带,并用β-肌动蛋白标准化。每组n=5,数据显示为平均值±SEM,与对照相比,*p<0.05,**p<0.01,未配对t检验。(C) AEP活性测定来自无菌3×Tg小鼠和SPF3×Tg小鼠的脑裂解物。与无菌3×Tg小鼠相比,SPF3×Tg小鼠的AEP活性升高。数据代表平均值±SEM;五个样本的代表性数据;**与对照相比,p<0.01,未配对的t检验。(D)来自无菌3×Tg小鼠和SPF3×Tg小鼠的脑裂解物中促炎细胞因子IL1-β、IL-6和TNFα浓度,数据代表平均值±SEM;五个样本的代表性数据;***与对照、多重未配对t检验相比,p<0.001。(E)定量RT-PCR分析来自GF小鼠与spf小鼠的脑样本,比较C EBPb靶向AA通路基因。AA,花生四烯酸;AEP,天冬酰胺内肽酶;COX,环氧合酶;SPF,无特定病原体。
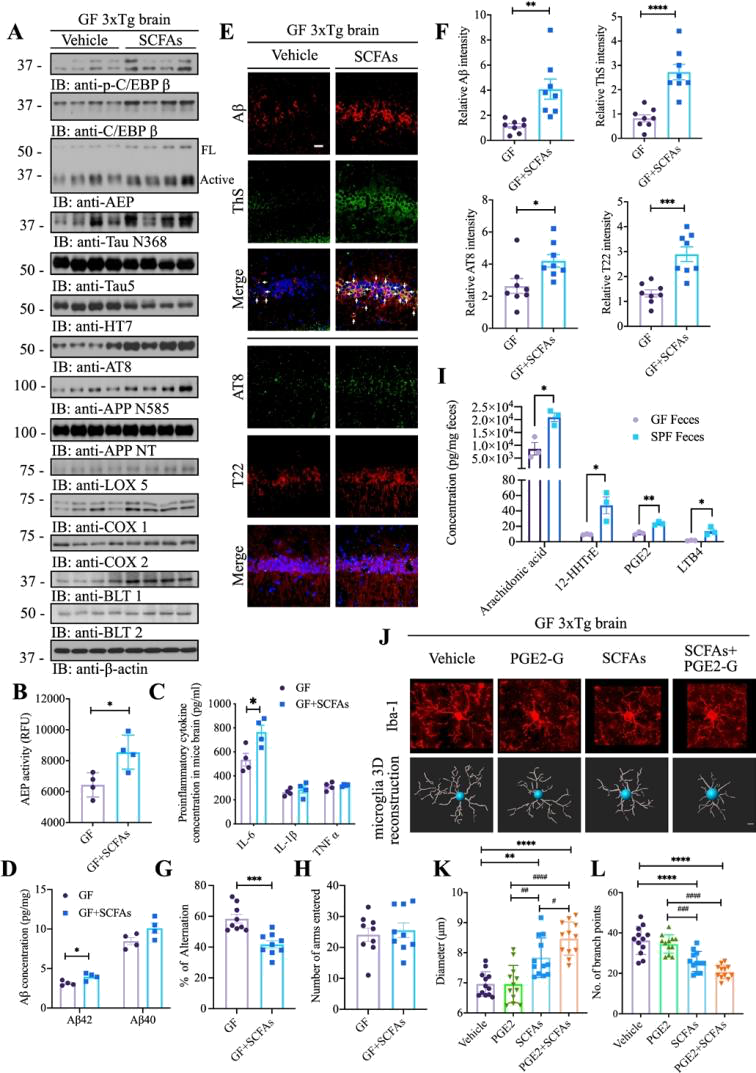
(图据Gut)
图2 SCFA触发C EBPβ AEP激活和GF3×Tg小鼠的认知缺陷和炎症,并被PGE2-G加剧。 (A)免疫印迹显示p-C EBPβ、C EBPβ、AEP、APP和tau的表达和加工,以及给予或不给予 SCFAs的GF小鼠大脑中的花生四烯酸代谢。(B)在给予或不给予SCFA的情况下,对来自 GF3×Tg小鼠的脑裂解物的AEP活性测定。SCFAs治疗提高了GF3×Tg小鼠大脑中的AEP活性。数据代表平均值±SEM;四个样品的代表性数据;*p<0.05与对照、未配对t检验相比。 (C)分别来自GF3×Tg小鼠和SPF3×Tg小鼠的脑裂解物中促炎细胞因子IL1-β、IL-6和TNFα 浓度。数据代表平均值±SEM;四个样品的代表性数据:*p<0.05与对照、多个未配对T检验相比。(D)使用人Aβ40和Aβ42 ELISA试剂盒测量给予或不给予SCFA的GF3×Tg小鼠皮质中的Aβ40和Aβ42浓度。与载体处理的GF3×Tg小鼠相比,SCFA处理的GF3×Tg小鼠大脑皮层中Aβ42而非Aβ40的浓度显著增加。(每组N=4,数据显示为平均值±SEM *与对照相比,p <0.05,多个未配对测试)。(E)来自GF3×Tg的大脑海马CA1区Aβ(红色)和ThS(绿色)、AT8(绿色)和T22(红色)的免疫荧光染色给予或不给予SCFA的小鼠。比例尺:20 µm。(F)定量分析Aβ阳性细胞、ThS阳性细胞、AT8阳性细胞和T22阳性细胞。在SCFAs处理的GF3×Tg小鼠脑中,Aβ、ThS、AT8和T22阳性细胞的密度显著增加。(每组n=8,数据显示为平均值±SEM。*P<0.05,**p<0.01,***p<0.001,****p<0.0001,与对照组相比,未配对T测试) 。 (G, H)Y-迷宫行为测试。自发交替(%) (G)入臂次数(H);(每组N=9,数据以平均值±SEM表示。***与对照、未配对测试相比,P<0.001)。(I) GF小鼠和SPF小鼠粪便中花生四烯酸及其代谢物的浓度。(每组N=3,数据显示为平均值±SEM,与对照相比,*p<0.05,**p<0.01,多个未配对T测试)。(J) GF3×Tg小鼠皮质中Iba-1(红色)免疫荧光染色的代表性图像(上图)和Iba-1染色小胶质细胞(下图)的3D重建,GF3×Tg小鼠用PGE2-Gor SCFAs治疗,用SCFAs 和PGE2-G处理的GF3×Tg小鼠。(K, L)小胶质细胞在皮层的直径、分支点数量的定量分析。数据代表平均值±SEM;十二个样品的代表性数据;**p<0.01, ***p<0.001, ****p<0.0001与对照相比,多重未配对测试;P<0.05, P< 0.01, P< 0.001, P<0.0001与对照相比,多重未配对t检验。Aβ,淀粉样蛋白-β;AEP,天冬酰胺内肽酶;GF,无菌;PGE2-G,前列腺素E2-1-甘油酯;SCFA,短链脂肪酸。