神经炎症和突触功能障碍中的微生物群:关注阿尔茨海默病
Microbiota in neuroinflammation and synaptic dysfunction: a focus on Alzheimer’s disease
神经炎症和突触功能障碍中的微生物群:关注阿尔茨海默病
摘要译文
背景:肠道微生物群对健康和疾病状态下大脑功能的调控是一个新颖、新兴的概念。众多的数据表明,肠道微生物群在一定程度上通过调节神经炎症发挥作用。基于神经炎症变化与神经元活动之间的关系,肠道微生物群可能通过影响神经炎症的关键参与者小胶质细胞,间接影响神经元功能。事实上,越来越多的证据表明,小胶质细胞和突触功能障碍之间的相互作用可能涉及微生物群等因素。微生物群除了可以间接依赖小胶质细胞对神经元活动的影响外,最近发现也可以通过刺激迷走神经直接影响神经元活动。
主要信息:阿尔茨海默病是研究最多的神经退行性疾病之一,也是全球痴呆症的主要病因。通过关注阿尔茨海默病,探讨微生物群对神经元活动的间接和直接影响的推定机制。更具体地说是在外周和中枢炎症串扰的背景下,探讨微生物群介导的小胶质细胞改变的机制。接下来,我们重点关注微生物群对外周免疫中体液介质的调节作用及其对迷走神经刺激的影响。最后,我们讨论了微生物群的扰动是否以及如何影响突触神经传递和下游认知功能障碍。
结论:越来越多的证据支持肠道微生物群在阿尔茨海默病发病机制中的作用,包括对突触功能障碍和神经炎症的影响,这些影响会导致认知能力下降。基于微生物群调节的推定早期干预策略对阿尔茨海默病似乎有治疗前景,但仍需进一步研究。
原文链接
https://molecularneurodegeneration.biomedcentral.com/articles/10.1186/s13024-022-00522-2
Bairamian D, Sha S, Rolhion N,et al. Mol Neurodegener. 2022 Mar 5;17(1):19.
解读人:周亚芳 博士
中南大学湘雅医院老年神经内科副主任医师,医学博士。
中国老年医学学会认知障碍分会委员,湖南省医学会神经病学专业委员会痴呆与认知障碍学组委员,湖南省预防医学会老年病预防与控制专业委员会青年委员会副主委,湖南省老年医学学会老年综合症分会青年委员,中国医师协会神经内科医师分会帕金森病与运动障碍专业委员会委员。

文献解读
2022年3月法国学者Slavica Krantic在Molecular Neurodegeneration发表了题为“Microbiota in neuroinfammation and synaptic dysfunction: a focus on Alzheimer’s disease”(神经炎症和突触功能障碍中的微生物群:关注阿尔茨海默病)的综述,系统阐述了神经炎症与突触功能障碍在认知功能障碍中的相关作用,并提出基于微生物群调节的早期干预策略在治疗阿尔茨海默病方面的治疗前景,但仍需进一步研究。
与年龄相关的神经退行性疾病如阿尔茨海默病(AD)、帕金森病(PD)和亨廷顿病(HD),其病理改变往往比临床诊断早很多年。大脑中的慢性炎症反应即神经炎症,是这些疾病常见的早期病理改变。值得注意的是,突触功能障碍也发生在这些疾病的早期阶段,包括症状前阶段。但是,当认知症状轻微或无法检测到时,尤其是在这些病理的症状前阶段,神经炎症与突触功能障碍之间的关联能否提示认知障碍,目前尚不清楚。
肠道微生物群最近已成为中枢神经系统稳态和功能障碍的一个重要贡献者。肠道微生物群的改变,除了会引起胃肠道疾病外,还可能增加肠道与血脑屏障(BBB)的通透性。这些通透性改变可能促进肠道微生物群衍生分子(如脂多糖)和代谢物(如短链脂肪酸)等在脑组织的蓄积,随后大脑内环境向亲炎症状态转变,为神经退行性疾病如AD、PD的发生发展创造条件。微生物群引发的其他病理改变可能依赖于其代谢产物循环水平的增加,以及外周免疫系统中体液(如促炎症细胞因子)或细胞(如单核细胞)因子的增加。沿着这个思路,微生物群调节调节性T细胞(Treg)与小胶质细胞的功能,而小胶质细胞在功能上对应于脑内巨噬细胞。总之,外周免疫系统和中枢神经炎症反应之间的相互作用可能是神经退行性疾病中神经病理病变机制的一部分。
基于目前最新理论,微生物群可能在外周免疫反应、神经炎症和神经退行性变之间的相互作用中发挥重要作用。然而,确切的潜在机制仍有待研究发现。在这篇综述中,作者首先介绍了在广泛的生理与病理背景下,神经元活动、免疫系统介质和微生物群之间相互作用的证据。然后,在AD的特定疾病背景下讨论了微生物群的新作用。作者提供了跨多学科领域(神经科学、免疫学、微生物学)的综述,进一步探讨微生物群在神经炎症背景下对突触功能影响(图1)。最后,作者讨论了微生物群调节的可能策略,即以间接(通过微生物群对外周炎症的调节)或直接(通过迷走神经刺激)改善AD相关神经元功能障碍(图2);并陈述了微生物群调节对AD早期干预的可能治疗价值,以及对其它神经退行性疾病的启发。
目前可用于AD的治疗大多是症状性的,治疗效果相对有限,因此,有必要开发更有效和早期阶段适用的治疗方法。由于肠道微生物群的改变导致大脑活动的改变,因此,调控肠道微生物群已成为AD的潜在治疗目标。使用不同策略调节微生物群(益生元或益生元治疗、FMT等)的数据令人鼓舞,这似乎有助于改善认知障碍。最近报道的研究结果表明,AD动物模型的症状前阶段已经能检测到微生物群的变化,强烈表明在AD发病的早期阶段调控肠道微生物群可能是有益的。
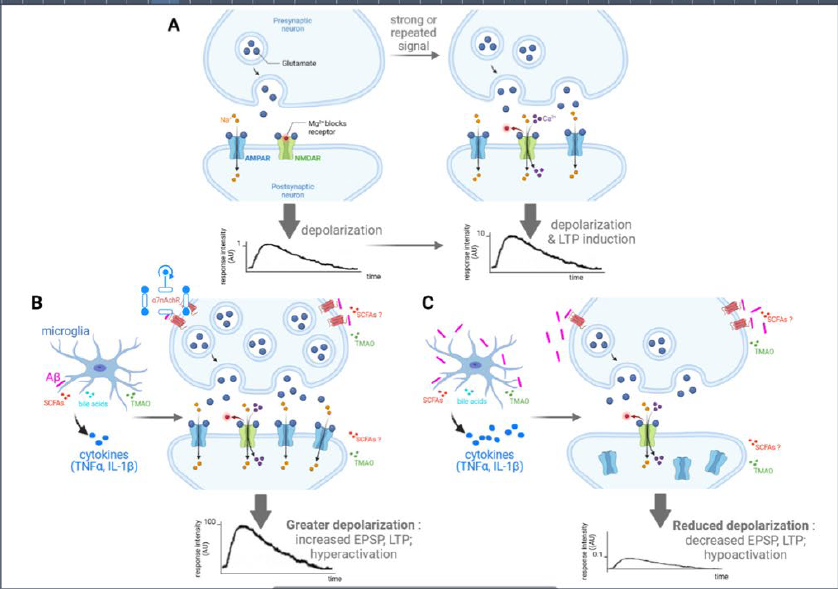
(图据Molecular Neurodegeneration)
图1 在生理和AD样病理动物模型上,微生物群产物调节LTP的诱导和表达。(A)在生理条件下,突触前海马神经元的输入会触发谷氨酸在突触间隙的释放,激活突触后神经元膜的AMPAR,Na+进入神经元,产生兴奋性突触后电位(EPSP)。当给予强直刺激时,突触前膜释放大量谷氨酸,增加突触后膜产生EPSP,导致NMDAR中阻断的Mg2+去除并随后被激活。NMDAR激活允许Ca2+和Na+离子流入神经元,导致钙调素依赖性蛋白激酶II的激活,磷酸化AMPAR,增加其电导率,促进AMPAR从细胞质转移到突触后膜,并增加其密度,导致LTP。(B)AD样病理的早期阶段可能与突触前神经元谷氨酸释放增加和突触间隙内及周围谷氨酸浓度增加有关。事实上,Aβ可以通过激活突触前神经元上的α7nAchR刺激谷氨酸释放,并有助于突触前易化。在Aβ积累的病理状态下,小胶质细胞产生的炎症细胞因子,如TNFα和IL-1β,可以上调突触后膜AMPAR的表达,导致更高的离子内流和更大的去极化。所有这些突触水平的变化都会导致海马神经元过度激活,并在AD的早期阶段增加LTP。(C)AD病理的晚期以谷氨酸能神经传递的低活性为特征,Aβ水平升高通过抑制α7nAchRs减少了突触前神经元的谷氨酸释放,从而减少NMDAR的突触后激活。此外在AD病理的早期阶段,AMPAR的慢性刺激导致受体的脱敏和内化。由于Aβ持续蓄积导致的毒性环境,小胶质细胞过度产生促炎细胞因子(例如TNFα、IL-1β......),可触发神经元凋亡和垂死神经元释放谷氨酸,从而加剧神经毒性。总而言之,这导致与认知缺陷相关的LTP和EPSP减少(以及LTD的镜像增加,为清楚起见,图中未显示)。
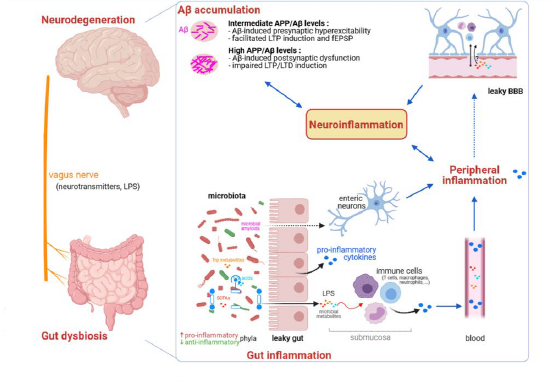
(图据Molecular Neurodegeneration)
图2 肠道菌群失调与AD发病机制之间的潜在关联。AD患者肠道微生物群组成和功能的改变增加了肠道屏障及血脑屏障的通透性,从而在肠道和CNS之间形成促炎的恶性循环。AD早期阶段(低浓度Aβ)随着谷氨酸能神经传递增加,海马锥体神经元兴奋性增加,进而转化为突触前易化、增强fEPSP和LTP。相反,AD后期阶段(高浓度Aβ),fEPSP的显著降低、LTP的降低和LTD的增强,可能与突触AMPA受体数量的减少和进行性记忆丧失有关。