肠道菌群介导的阿尔茨海默病的炎症通路
摘要
近十年来,大量研究表明肠道菌群与阿尔茨海默病(AD)的发生发展密切相关,但具体机制尚不清楚。神经炎症和全身炎症都是通过促进病理进程和破坏神经元来加速AD进程的关键枢纽。更重要的是,肠道菌群对炎症的调节也至关重要。因此,本综述重点关注肠道菌群通过炎症通路在AD中的作用。首先,这篇综述总结了肠道菌群、炎症和AD之间的关系和相互作用。其次,描述了肠道菌群通过炎症通路对AD的直接和间接调节作用。这些作用主要由肠道菌群的成分(脂多糖和淀粉样肽)、细菌的代谢物(短链脂肪酸、支链氨基酸和神经递质)和功能性副产物(胆汁酸)介导。此外,还通过这些机制讨论了AD的潜在治疗方法(粪菌移植、抗生素、益生菌、益生元和饮食干预)。最后,根据目前的研究现状,提出了未来研究中需要解决的关键问题。
关键词:阿尔茨海默病,肠道菌群,神经炎症,系统性炎症
原文链接:
https://linkinghub.elsevier.com/retrieve/pii/S1568-1637(21)00064-7
Qian XH, Song XX, Liu XL, et al. Ageing Res Rev. 2021;68:101317.
解读人 于继徐 教授 山东省临沂市人民医院神经内科副主任医师
文献解读
2021年3月上海交通大学瑞金医院神经内科陈生弟、汤荟冬教授团队在国际知名杂志Ageing Research Reviews(《衰老研究综述》)发表了题为《肠道菌群介导的阿尔茨海默病的炎症通路》的综述,系统、全面地从炎症角度介绍了肠道微生物在阿尔茨海默病(Alzheimer’s disease, AD)发病中的作用。
AD最主要的两个神经病理性标志物是由β-淀粉样蛋白(Aβ)聚集而成的细胞外神经炎性斑块和由过度磷酸化Tau蛋白聚合而成的神经元内神经纤维缠结(NFTs),这是AD发病机制经典假说。然而,这些假说不能够完全解释AD发生发展中的一些现象。在AD病人的脑中,我们观察到在错误折叠和聚集的蛋白质周围,小胶质细胞和星形胶质细胞聚集,许多炎症通路被激活并且释放了多种炎症因子。因此,调控免疫系统介导的炎症可能是延缓和阻止AD进程的关键。
神经炎症和全身性炎症在AD发病中扮演了重要的角色。研究显示AD病人较轻度认知障碍(mild cognitive impairment,MCI)病人神经炎症的水平更高,分布更广。中枢神经系统炎症反应主要由小胶质细胞和星形胶质细胞介导,促炎物质和信号直接或间接激活小胶质细胞和星形胶质细胞,促进炎症反应。全身性炎症在AD中枢神经系统中起到了促炎作用。例如,全身炎症水平较高的代谢综合征病人更容易发生认知障碍。中性粒细胞可能加速神经炎症和慢性血脑屏障损伤,从而进一步促进认知障碍和神经病理学的产生。神经炎症和全身炎症都是AD发病机制的重要组成部分,见图1。

(图据Ageing Research Reviews)
图1. AD炎症机制模型。AD早期,当中枢静息性小胶质细胞和星形胶质细胞受到全身性炎症或中枢Aβ刺激时,通过激活TGF-信号通路活化成抗炎M2亚型小胶质细胞和A2亚型星形胶质细胞,然后分泌抗炎因子和神经营养因子来修复神经元和吞噬异常蛋白发挥代偿作用。而在AD中晚期失代偿期,促炎M1亚型小胶质细胞和A1亚型星形胶质细胞通过NF-kB、MAPK途径被激活并分泌促炎细胞因子。然而,这些促炎细胞因子通过上调BACE1、PS1、APP,通过激活GSK-3、CDK5使Tau蛋白过度磷酸化,促进Aβ的产生,形成恶性循环,加速AD的进展。TGF-β,转化生长因子β;TLRs,Toll样受体;PPPs,模式识别受体;SRs,清道夫受体;IL-1R,白介素1受体;IL-17R,白介素17受体;TRKB-T1,截短的原肌凝蛋白受体激酶B;BBB,血脑屏障;C3,补体3;Aβ,β-淀粉样蛋白;STAT3,信号传导和转录激活因子3;NF-kB,核因子-kB
在过去十年中,AD研究中最重要的发现是肠道菌群的失调。AD病人和MCI病人都存在肠道菌群失调。因此,肠道菌群失调被认为是AD的临床前症状。此外,通过不同的策略调节AD病人的肠道菌群已成为治疗AD的非常具有潜力的方法。然而,目前还不清楚肠道菌群是如何参与AD的发生发展过程的。因此,进一步了解肠道菌群与AD之间的联系,将会为AD的早期诊断和治疗开辟新的途径。
肠黏膜淋巴组织被认为是人体最大和最重要的免疫器官,占人体免疫系统的70%-80%。因此,人体免疫系统通过许多信号通路在宿主与肠道菌群之间的平衡维持和沟通中发挥着至关重要的作用。然而,一旦因衰老、疾病等因素导致微生物与宿主免疫系统的交互作用失衡,那么肠道菌群和益生菌的多样性将会减少,并导致致病微生物增加。肠道菌群处于平衡状态具有抗炎作用,菌群失调则会导致炎症反应。菌群失调可以加速AD等年龄相关性疾病的发生发展。病人和动物水平的研究明确了肠道菌群与AD的关系密切,但其具体作用机制尚不清楚,炎症通路可能是其重要环节。
最近,一些研究发现微生物或其碎片存在于AD病人的血液和脑组织中。例如,不仅在AD病人和正常对照组的血液中检测到微生物菌群的属水平差异,而且在MCI和正常对照组的血液中也检测到微生物菌群的属水平差异。此外,在AD脑组织中也检测到了微生物碎片,如脂多糖、肠毒素、微生物源性淀粉样蛋白。因此,肠道菌群和/或其生物聚合物如何进入血液系统甚至脑组织,以及它们如何参与AD病理过程已成为该研究的关键部分。令人信服的解释之一是,肠道菌群及其生物聚合物,包括脂多糖、肠毒素、微生物源性淀粉样蛋白和小型非编码RNA(sncRNA),在各种黏膜屏障的防御下,通过强烈的神经毒性和促炎作用促进AD的进程。
特定的结肠细菌,如拟杆菌、双歧杆菌、梭菌,发酵膳食纤维释放短链脂肪酸。研究证实,短链脂肪酸在tau蛋白磷酸化和神经炎症中也发挥了重要作用。
近年来,支链氨基酸(BCAAs)与AD的关系得到了证实。循环系统中的BCAAs主要来自三个方面:膳食摄入、组织中蛋白质的降解和肠道菌群的产生。在血清中,BCAAs(亮氨酸、缬氨酸和异亮氨酸)的浓度与AD风险呈负相关。这与高缬氨酸水平与较慢的认知衰退和脑萎缩有关的结果是一致的。然而,孟德尔随机化分析显示,血浆中异亮氨酸浓度增加的遗传易感与AD呈正相关。适当浓度的BCAAs对免疫细胞的正常生长是必要的。但BCAAs浓度过高可能起到促炎作用。BCAAs在AD中的免疫调节作用有待进一步阐明。
被证实异常改变的神经递质系统参与了AD的发生发展。更重要的是,这些神经递质通过免疫细胞表面的不同受体在神经炎症和全身炎症中发挥着不同的作用。最近,肠道菌群也被确定产生和/或作出反应的几种神经递质,包括DA、NE、His、5-HT或GABA。这些神经递质可以通过血液循环或神经传导调节大脑功能。因此,肠道微生物源性神经递质可能在AD的神经炎症调节中发挥基础性作用。见图2。
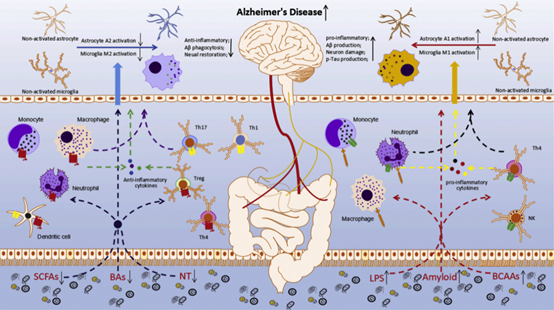
(图据Ageing Research Reviews)
图2. 肠道菌群通过炎症通路参与AD发病机制。在AD患者的肠道,由于炎性细菌的增多、抗炎细菌的减少,导致炎性细菌产物(LPS和淀粉样蛋白)和代谢物(BCAAs)增加,而抗炎代谢物减少或占比减少(SCFAs,BA,NTs)。这些改变促进了AD的全身炎症和神经炎症,通过促进Aβ的产生、Tau蛋白的过度磷酸化和神经元损伤,减少Aβ的清除和神经元修复,从而加速了AD的进展。LPS,脂多糖;SCFAs,短链脂肪酸;NTs,神经递质;BCAAs:支链氨基酸;Bas,胆汁酸;Th4,Th4辅助T细胞;Th1,Th1辅助T细胞;Th17,Th17辅助T细胞;Treg cell,调节性T细胞
综上所述,肠道菌群直接或间接参与了外周和中枢炎症的调节。它似乎在AD的进展和发病机制中起着重要作用。那么,如何通过这种菌群-脑相互作用途径来干预AD的过程呢?根据目前的研究,主要有以下临床前或临床研究的干预,包括抗生素治疗、益生菌、益生元、粪便菌群移植、饮食干预等。其中,抗生素、益生菌、菌群移植可促进AD病人肠道菌群由促炎型向抗炎型转化。益生菌或饮食变化不仅为肠道菌群提供促进抗炎产品生产的底物,还改变了肠道菌群的组成。
炎症这一恶性循环过程涉及增加Aβ形态发生途径,抑制小胶质细胞对Aβ形态发生的清除,诱发神经元损伤,以及Tau蛋白过度磷酸化形成纤维缠结。微生物-肠-脑轴是近年来的一个热门话题。肠道菌群与AD之间的相互作用也已得到证实。炎症通路是相互之间的重要桥梁之一。然而,目前的研究大多局限于肠道菌群、炎症和AD之间的关系,它们之间的明确沟通机制尚未阐明。因此,未来的研究有几个方面需要重点关注。首先,肠道菌群是在什么时期发生变化的?在AD发病之前还是之后?即肠道菌群失衡与AD之间的因果关系。其次,SCFAs等肠道微生物代谢产物在AD中的炎症调节作用是什么?第三,来自肠道微生物的神经递质是否参与了AD的中枢病理过程?最后,外部干预如何准确重构微生态系统的免疫平衡来治疗AD?