阿尔茨海默病中的神经炎症和小胶质细胞激活:我们何去何从?
摘要
阿尔茨海默病(AD)是最常见的神经退行性疾病,估计占全球所有痴呆症病例的60%-70%。根据流行的淀粉样蛋白级联假设,大脑中的β-淀粉样蛋白(Aβ)沉积是AD的起始事件,尽管越来越多的证据表明该假设不足以解释AD发病机制的许多方面。AD患者炎症标志物水平升高的发现以及与先天性免疫功能相关的AD风险基因的确认表明,神经炎症在AD的发病机制中发挥了重要作用。在这篇综述中,我们讨论了神经炎症与淀粉样蛋白和tau蛋白病理之间的相互关系,以及神经炎症对AD疾病轨迹的影响。我们特别关注在神经炎症中扮演主要角色的小胶质细胞,并讨论在不同条件下观察到的小胶质细胞表型在空间和时间上的变化。我们还考虑如何调节这些细胞作为AD的治疗策略。
原文链接:
https://www.nature.com/articles/s41582-020-00435-y
Leng F, Edison P. Nat Rev Neurol. 2021;17(3):157-172.
解读人:楚长彪教授 首都医科大学宣武医院神经内科副主任医师
文献解读
2021年3月,伦敦帝国理工学院脑科学系Paul Edison教授团队在国际顶级期刊Nature Reviews Neurology(《自然综述神经学》)发表题为《阿尔茨海默病中的神经炎症和小胶质细胞激活:我们何去何从?》的综述,该文详细梳理了小胶质细胞与β-淀粉样蛋白(amyloid-β,Aβ)和tau蛋白病理之间的相互关系,以及神经炎症对阿尔茨海默病(Alzheimer’s disease,AD)疾病轨迹的影响,并探讨了可能的治疗策略。
AD脑内的病理特征为Aβ和异常的tau蛋白缠结,但越来越多证据提示Aβ级联假说并不能解释很多AD病理,这提示还有其他病理过程存在。近期AD炎症标志物水平提高以及与免疫功能相关的AD风险基因的发现,让人们认识到炎症也是发病机制的重要参与者。
神经炎症研究表明,小胶质细胞参与神经退行性变。在AD人群的大脑中,反应性小胶质细胞与淀粉样斑块存在紧密共定位,这提示Aβ与小胶质细胞之间存在相互作用。病理性tau与小胶质细胞负荷之间的联系在尸检和活体神经影像研究中也已有描述。因此,淀粉样斑块、神经元纤维缠结以及小胶质细胞激活之间的相互作用引出了淀粉样蛋白级联-炎症假说,此假说认为小胶质细胞的激活扮演了一个桥梁的作用,从而导致tau的病理性磷酸化和聚集。
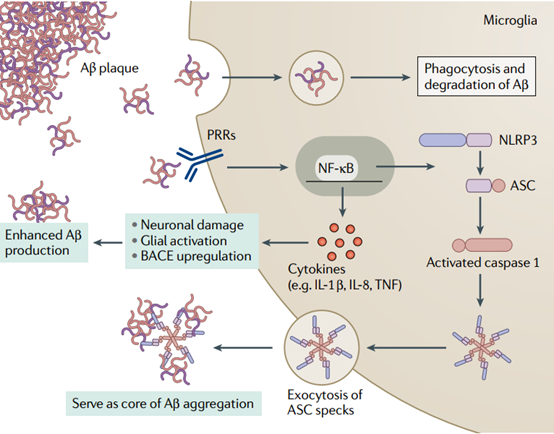
小胶质细胞用来识别Aβ种类的受体主要是模式识别受体,这些受体依次激活诱导了小胶质细胞表型改变的分子通路(图1)。NLRP3炎症小体的募集、小胶质细胞上的补体受体和Fc受体也是介导吞噬作用和促炎反应的关键环节。另一个需要注意的小胶质细胞受体是TREM2,在AD患者和小鼠模型的斑块相关小胶质细胞上发现了TREM2表达增强,TREM2信号可促进小胶质细胞增殖、吞噬和细胞因子分泌,并调节小胶质细胞代谢和存活。
活化的小胶质细胞具有Aβ吞噬功能,但吞噬后Aβ降解相当缓慢。小胶质细胞对不同Aβ种类有不同的反应,可吞噬原纤维而不是低聚物,后者会优先诱导炎性细胞因子的产生并抑制纤维性Aβ的吞噬作用。对晚期AD患者脑组织的病理检查发现,小胶质细胞在形态上处于营养不良状态,其分支长度和覆盖面积减少表明监控功能的丧失。唐氏综合征或AD患者淀粉样斑块附近表达TREM2和CD68的小胶质细胞数量有限,也表明斑块相关小胶质细胞的吞噬功能减弱。
Tau疾病小鼠模型研究进一步证实了体内存在tau诱导的小胶质细胞激活。然而,人脑病理证据发现,与tau病理相关的小胶质细胞表现出形态退化、功能受损,这可能是由小胶质细胞衰老或慢性淀粉样蛋白中毒引起的,并在时间上先于tau病理学的散播。此外,与Aβ的相互作用类似,小胶质细胞似乎通过吞噬和外泌体分泌积极散播tau,在AD病理学的背景下,Aβ与小胶质细胞协同作用可加剧tau病理改变。
上述相互作用的复杂性可能归因于小胶质细胞对不同刺激的不同反应。TREM2–TYROBP通路主要是一种小胶质细胞信号通路,超过一半由Aβ–TREM2–TYROBP共表达诱导的通路与由tau–TREM2–TYROBP诱导的一致,这表明小胶质细胞是tau和淀粉样蛋白毒性的共同介导者或桥接因子。另一方面,研究发现TREM2信号可以抑制Aβ诱导的一半通路,这意味着小胶质细胞具有防御作用。而在tau-TREM2-TYROBP共表达模型中,小胶质细胞可加剧tau介导的神经退行性变,这又反映出小胶质细胞对Aβ和tau的不同反应。
鉴于上述发现,综述进一步论述了目前与之相关且普遍获得支持的神经炎症模型(图2):随着年龄增长而发生的慢性背景炎症提供了一种初始轻度刺激,导致小胶质细胞启动,随着Aβ沉积的出现,在AD的临床前阶段可能出现小胶质细胞活化的防御行为。Aβ的无效清除与tau聚集结合会损害小胶质细胞的防御功能,并在晚期AD中引发持续的有害小胶质细胞激活过程。初始反应的有效性和持续性受个体易感性和先前基线炎症的影响,这可能使小胶质细胞向防御能力受损和向晚期有害状态转化的趋势增加的表型分化。
针对上述机制,综述中也探讨了3个与之相关的治疗启示:1. 通过抑制促炎特性来限制小胶质细胞激活的有害影响;2. 通过调节小胶质细胞的表型变化来促进保护性抗炎特性;3. 在疾病过程的早期影响小胶质细胞启动。
综述结论提示,神经炎症在AD发生发展中起着至关重要的作用。小胶质细胞对病理刺激的不同反应对AD的进展有重大影响,这一动态过程在疾病轨迹上具有不同的作用;小胶质细胞反应取决于个体的敏感性,并且可能受到先前小胶质细胞启动的影响;当疾病过程开始时,在疾病前期以小胶质细胞启动为干预目标,调节脑内小胶质细胞反应,将是一种很有前景的疾病治疗策略。这与目前提倡的AD预防和早诊早治不谋而合。
(图据Nature Reviews Neurology)
图1. 小胶质细胞对Aβ种类的反应。 Aβ种类可以被小胶质细胞上的一系列模式识别受体 (PRR)识别,从而进一步激活吞噬细胞或炎症通路。它们吞噬能力的上调使小胶质细胞能够内化和降解Aβ,并且核因子-κB(NF-κB)通路的激活导致促炎细胞因子的表达和包含 pyrin结构域3(NLRP3)炎症小体的组装。NLRP3炎症小体激活可导致释放包含C端半胱天冬酶募集结构域斑点的凋亡相关斑点样蛋白(ASC),其可作为Aβ聚集的结合核心。促炎细胞因子的释放可以促进进一步的神经胶质激活、神经元损伤和β-分泌酶 (BACE) 的上调,BACE是一种参与致病性Aβ种类产生的酶。TNF,肿瘤坏死因子。

(图据Nature Reviews Neurology)
图2. 小胶质细胞激活的动态变化影响AD的进展。这张图解释了为什么小胶质细胞功能缺陷的患者(例如,由于获得性或遗传易感性)可能会在AD的早期病理阶段出现认知能力下降,这是由他们的淀粉样蛋白和tau蛋白负荷的动态变化定义的,而那些小胶质细胞功能正常的患者则没有。目前证据表明,在AD的早期、无症状阶段,最初的小胶质细胞反应总体上是保护性的。然而,随着AD的进展,慢性激活会导致小胶质细胞的表型变化,并将其行为转变为促炎表型,从而导致神经元网络受损。由于遗传或获得性因素(如小胶质细胞启动),保护功能有缺陷的个体可能会发生不适当的小胶质细胞反应。这些个体中的小胶质细胞可能具有较弱的初始保护反应,更快地转变为对整体有害的表型,以及严重的晚期有害炎症反应。因此,个体对AD的易感性(就特定病理阶段的更深刻的临床表现而言)可能部分由小胶质细胞行为决定。MCI,轻度认知障碍。