小胶质细胞激活和tau在Braak分期中共同传播
摘要
令人信服的实验证据表明,在阿尔茨海默病(AD)中,小胶质细胞的激活参与了新皮质tau蛋白缠结的扩散。我们测试了小胶质细胞激活和tau蛋白积累的空间传播在活人大脑中以 Braak样模式共定位的假设。我们使用正电子发射断层扫描脑成像研究了130名不同年龄和 AD临床谱的个体的小胶质细胞激活([11C]PBR28)、β-淀粉样蛋白(Aβ)([18F] AZD4694)和tau([18F]MK-6240)病理。我们进一步评估了小胶质细胞髓样细胞触发受体2(TREM2)的脑脊液(CSF)浓度和脑基因表达模式。我们发现 [11C]PBR28与脑脊液可溶性TREM2相关,并显示出类似于TREM2基因表达的区域分布。网络分析显示,小胶质细胞激活和tau蛋白与Braak分期在层次上相互关联。回归分析显示,tau蛋白的纵向传播途径依赖于基线小胶质细胞网络,而不是tau蛋白网络环路。在我们的研究人群中,Aβ、tau蛋白和小胶质细胞异常的同时发生是认知障碍的最强预测因子。我们的研究结果支持一个模型,即Aβ和活化小胶质细胞之间的相互作用决定了tau蛋白在Braak分期中的传播速度。
原文链接:
https://www.nature.com/articles/s41591-021-01456-w
Pascoal TA, Benedet AL, Ashton NJ, et al. Nat Med. 2021;27(9):1592-1599.
解读人:张书刚 南京脑科医院神经内科副主任医师
研究解读
2021年8月,美国匹兹堡大学医学院的精神病学和神经病学教授Tharick A. Pascoal 在Nature Medicine(《自然医学》)杂志上发表了题为《小胶质细胞激活和tau在Braak分期中共同传播》的研究论文。该研究使用正电子发射断层扫描成像(PET)对130名不同年龄和阿尔茨海默病(Alzheimer’s disease,AD)各阶段的个体进行扫描,研究小胶质细胞激活、β-淀粉样蛋白(Aβ)和tau蛋白病理在AD发展中的作用,为AD的治疗开辟了新的思路。
既往研究证明,AD的特征是Aβ形成淀粉样斑块和tau蛋白形成神经纤维缠结,这被认为是AD循Braak分期进展的经典病理解释。在先前的动物实验中发现小胶质细胞激活会驱动tau蛋白病理引发神经纤维缠结,但这一过程并未在人类研究中得到证实,故研究者假设在AD患者中小胶质细胞激活也可造成类似的tau病理,最终推动AD的进展。
Pascoal团队收集了130个具有TSPO基因表达高亲和力结合物的个体的临床资料、脑脊液(CSF)蛋白质生物标记物、磁共振成像(MRI)和PET数据,包括22名认知未受损的青年、64名认知未受损的老年人、28名轻度认知障碍(MCI)患者、16名AD患者,并额外收集了老年人1年后随访的tau PET扫描数据。研究发现,[11C]PBR28标准化摄取值比(SUVR)与典型AD影响区域表达的CSF小胶质细胞激活标记物可溶性髓样细胞触发受体2(TREM2)相关,同时CSF sTREM2与tau病理、萎缩、血管白质病理和认知损害高度相关,支持sTREM2与AD病理生理学之间的联系。在认知正常人群中,[11C]PBR28 SUVR随年龄增长逐渐升高。偏相关矩阵显示,包含Braak组织病理学分期的区域内的小胶质细胞激活水平从Braak I开始,各个阶段在层次上相互关联一直到Braak VI,两个基线网络(tau和小胶质细胞)的协变回归分析表明纵向tau传播途径取决于小胶质细胞网络而不是tau网络环路(图1)。体素相互作用模型显示,高水平的总体Aβ负荷和经嗅觉皮质中高水平的小胶质细胞激活与主要在同种皮质区域的tau负荷协同相关。同样,高水平的总体Aβ负荷和Braak IV区的小胶质细胞激活协同决定了广泛的新皮质tau。这表明小胶质细胞激活和tau蛋白沉积在空间上平行传播,遵循经尸检研究预测的穿内嗅带/内嗅到感觉运动皮质的脑环路,同时,Aβ可增强小胶质细胞激活对tau的扩散作用,最终导致广泛的脑损伤和认知障碍(图2)。
此外,通过计算生物标记物和痴呆症状之间的关系,他们发现Aβ、tau和小胶质细胞活化PET浓度之间存在协同作用,并与更差的简易精神状态检查评分高度相关(P=0.0003),提示Aβ、tau和小胶质细胞激活异常与认知损害高度相关。研究者分析,正常人脑内淀粉样蛋白沉积可随年龄增长,但并未发展为AD,而AD正是神经炎症和淀粉样斑块形成的共同作用推动tau蛋白扩散造成的病理改变,他们的研究结果支持小胶质细胞激活可能是与AD 进展相关的关键因素,这一发现有可能被纳入疾病的生物学定义。
综上,该研究证实了小胶质细胞激活推动tau蛋白在大脑皮质的传播,Aβ沉积的效应会增强这种作用,认为Aβ、tau和小胶质细胞激活异常是造成AD进展的最强预测因子。这为AD的治疗提供了新的思路,即在减少淀粉样斑块形成的同时抑制神经炎症的产生,这样的联合治疗可能有望控制疾病进展,甚至逆转脑内蛋白沉积的病理改变。
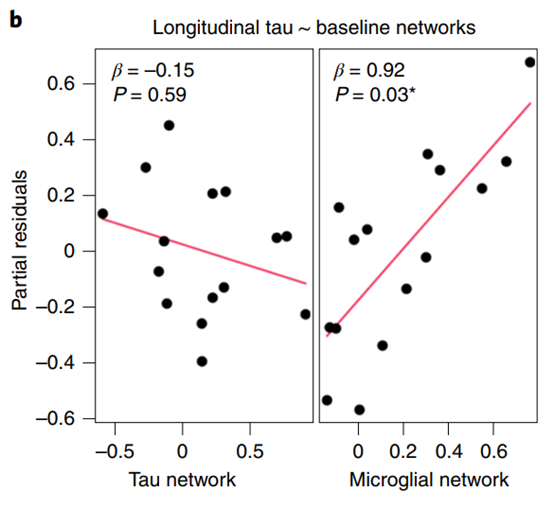
(图据Nature Medicine)
图1. Tau的纵向传播模式取决于基线的小胶质细胞网络环路。 偏残差图显示了同一模型中纵向tau传播网络与小胶质细胞激活-小胶质细胞激活和tau-tau两个网络协变量之间的线性回归结果。该模型表明,tau的纵向传播途径依赖于潜在的小胶质细胞,而不是tau环路。
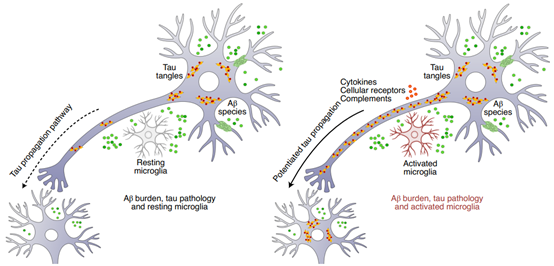
(图据Nature Medicine)
图2. 在存在Aβ病理的情况下小胶质细胞激活对tau传播影响的示意图。 大脑中Aβ、tau和活化的小胶质细胞的共定位增强了tau的传播(右图)。这个模型表明,Aβ和小胶质细胞的激活是两个部分独立的过程,当它们协同作用时,会导致新皮质tau病理。