肠道菌群和阿尔茨海默病:复杂的双向交互作用
The gut microbiome and Alzheimer's disease: Complex and bidirectional interactions
肠道菌群和阿尔茨海默病:复杂的双向交互作用
摘要译文
肠道菌群的结构和功能改变,被称为肠道菌群失调, 通过“脑-肠”轴成为神经退行性疾病和阿尔茨海默病(Alzheimer disease, AD)发病机制的潜在关键介质。动物实验和临床研究的新数据表明,肠道菌群失调在介导神经炎症、中枢和外周免疫失调、脑内异常蛋白质聚集、肠和脑屏障通透性受损方面发挥重要作用,导致神经元损伤和认知功能障碍。肠道菌群失调已被证实可以直接影响各种机制,包括神经元生长和修复、突触可塑性,以及记忆和学习功能。衰老和生活方式因素包括饮食、运动、睡眠和生活压力,可以通过肠道菌群失调影响AD发生风险。此外,AD具有独特的肠道菌群特征,可以作为疾病严重程度和进展的生物标记物。总之,这些研究发现表明AD和肠道菌群之间存在着复杂的双向关系,并突显了肠道调节策略作为AD潜在预防或治疗策略的实用性。本文回顾了当前的文献,关于“脑-肠”轴在AD发病机制中的作用,以及将其作为AD治疗和/或预防的未来治疗靶点的潜在作用。
解读人:王伟 博士
首都医科大学宣武医院神经内科副主任医师,博士,博士后
中国痴呆与认知障碍工作组委员、中国医疗保健国际交流促进会神经病学分会委员
作为项目负责人主持十四五国家重点研发计划1项,国自然面上项目1项,省部级课题3项,参与多项国自然和北京市自然科学基金

文献解读
2022年8月美国学者Rawan Tarawneh在Neurosci Biobehav Rev上发表了题为“The gut microbiome and Alzheimer's disease: Complex and bidirectional interactions”(肠道菌群和阿尔茨海默病:复杂的双向交互作用)的综述。该综述总结当前关于肠道菌群紊乱和AD病理机制的双向调节关系,全面阐述了导致肠道菌群失调和AD发生发展的病理生理机制。
阿尔茨海默病(AD)是最常见的痴呆类型,其主要的临床表现为进行性认知功能损害、行为改变和功能衰退。随着人口的老龄化,AD已经成为全球性的疾病卫生流行病中老年人发病和死亡的主要原因之一。AD可以分为家族性AD和散发性AD,后者占AD患者数量的95%左右。散发性AD是一种多因素疾病,其病因主要包括遗传易感基因、生活方式和环境因素的复杂相互作用。近年研究发现,在环境因素中肠道菌群在AD的发病和发展中起着重要的病理生理作用,肠道菌群失调通过“肠-脑”轴影响中枢神经系统的内稳态,从而导致AD发病(图1),肠道菌群和AD的病理生理关系逐渐引起了医学界的广泛关注。
1. 肠道菌群与AD之间双向关系的研究证据
该文献从AD动物模型和临床研究2个方面综述了肠道菌群改变和AD发病的相互关系。研究发现,AD动物模型由于饮食改变、药物使用或感染引起的肠道菌群的改变可以导致模型小鼠出现认知功能下降和AD样病理改变的进展,包括淀粉样蛋白生成增加、tau过度磷酸化聚集、突触功能障碍、免疫失调紊乱和神经炎症等病理改变。临床研究也证实微生物环境和AD 发病率之间的关系,发现卫生条件差的国家,AD 的发病率显著降低。在卫生条件好的国家,肠道菌群多样性更低,AD 的发病率更高。在发展中国家和乡村地区,微生物多样性更丰富并且有更充足的机会接触微生物。然而,在发达国家和城市地区,由于良好的环境卫生状况,对比发展中国家和乡村地区,不仅微生物多样性低,且接触微生物的机会少。相比于居住在发展中国家的居民,居住在发达国家的居民患AD的几率更高。近年利用宏基因组学的研究表明,生活方式可能比遗传因素更大程度上影响肠道菌群,以及显著增加AD的风险,衰老、睡眠、饮食、压力和运动与肠道菌群的种类和代谢存在密切联系,这些肠道菌群的改变影响着AD的发生和发展。
2.肠道菌群失调导致AD发病的病理生理机制
越来越多的证据支持肠道菌群在AD发病过程中介导认知障碍的病理生理机制,包括对肠道和血脑屏障的干扰障碍、免疫反应失调、氧化应激、神经炎症、淀粉样蛋白以及tau聚集、氧化应激和对突触功能的直接影响等。随着年龄的增长,肠道上皮层和血脑屏障的通透性增加,肠道菌群中代谢所释放的毒素包括脂多糖、多糖A和P-糖蛋白发生移位,一方面侵入肠道固有层和肠系膜淋巴结、激活免疫细胞,释放促炎因子进入血液循环系统,导致“肠源性炎症反应”,使肠道屏障和血脑屏障功能进一步受损;另一方面,大量肠道释放毒素可以直接通过血脑屏障进入脑内,与小胶质细胞的Toll 样受体结合,激活免疫–炎症反应,释放促炎因子产生神经炎症,进而导致脑内出现AD样病理生理改变出现认知功能下降的临床表现(图2)。
尽管各种肠道调节方式已经显示可减轻AD病理学改变和临床前认知功能下降的前景,然而,需要进一步的研究来证实其在人体中的安全性。中国的新药甘露钠在动物研究和临床实验方面都证实其具有调节肠道菌群和改善AD患者的认知功能,目前在中国已经批准上市,这是对肠道菌群调节治疗可以治疗AD的理论达到了进一步证实。面对目前AD药物研发面临的种种困境,通过调节肠道菌群治疗AD的关键靶点无疑是黑暗中的一盏明灯,祝愿不久的将来有更多基于该靶点的药物上市。

图1.肠-脑轴。示意图显示了大脑和肠道之间通过“肠-脑”轴的相互作用,包括由肠道分泌的毒素和代谢物,以及免疫系统的肠道调节,导致免疫细胞和炎症标志物在血脑中迁移障碍,中枢神经系统通过肠神经系统和下丘脑-垂体轴调节肠道运动和分泌。
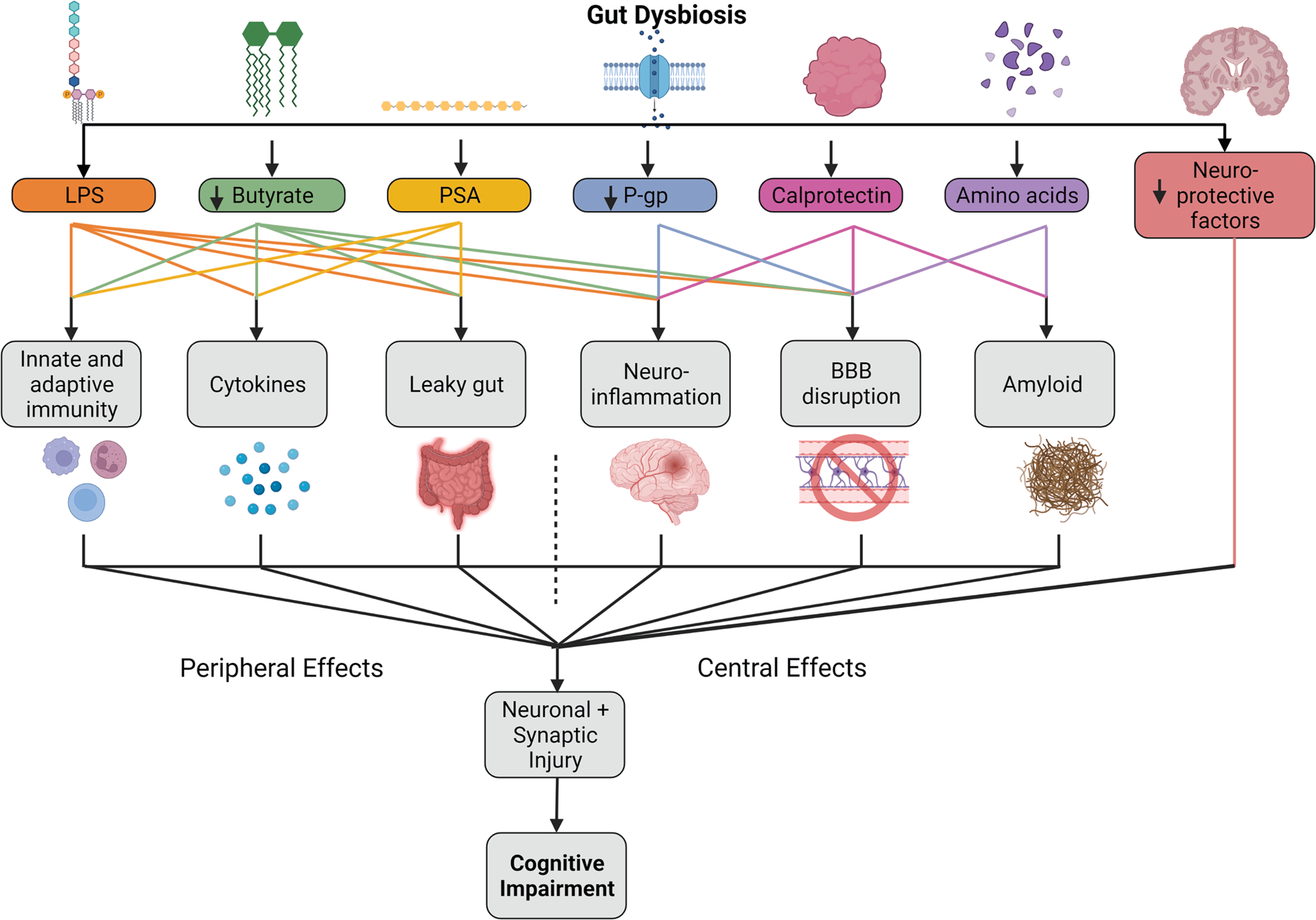
图2. 肠道菌群和肠道毒素、代谢物参与AD发病的潜在机制。动物和临床研究表明,肠道菌群有助于AD病理的发生和发展,包括先天免疫和适应性免疫的调节、神经炎症和细胞因子和其他炎症介质,增加血脑屏障通透性,降低肠屏障的完整性,导致“漏肠”促进毒素转移到循环中,增加蛋白质聚集,包括淀粉样蛋白、tau和突触核蛋白,并直接影响突触可塑性,记忆和学习过程。