阿尔茨海默病病理和认知减退对无认知损害的老年人淡漠、焦虑和抑郁症状发展的影响
Development of apathy, anxiety, and depression in cognitively unimpaired older adults: effects of Alzheimer’s disease pathology and cognitive decline
阿尔茨海默病病理和认知减退对无认知损害的老年人淡漠、焦虑和抑郁症状发展的影响
摘要译文
背景:阿尔茨海默病(AD)病理和认知缺陷对纵向神经精神症状的发生发展的影响尚不明确,特别是疾病的早期阶段。
方法:对纳入瑞典BioFINDER前瞻性研究的无认知损害的老年人(n=356)进行研究。神经精神评估包括淡漠评价量表和医院焦虑抑郁量表,两年评估一次(同时进行总体认知测试),持续8年。检测基线水平脑脊液或血浆生物标志物。通过磁共振成像量化脑白质病变。采用线性混合效应模型检验基线AD生物标志物(β-淀粉样蛋白、tau蛋白和神经变性)和白质病变与纵向随访的神经精神症状(淡漠、焦虑和抑郁症状)之间的相关性,以及认知改变与神经精神症状变化之间的相关性。最后,探讨认知改变是否介导各种脑部病理变化对神经精神症状的影响。
结果:基线β-淀粉样蛋白病理与纵向随访的淡漠(β=-0.284,p=0.005)和焦虑(β=-0.060,p=0.011)症状严重水平升高相关。随时间推移出现的较快速的认知减退与淡漠程度升高有关。基线β-淀粉样蛋白病理对纵向淡漠的影响部分通过认知功能介导(介导比例23%)。
结论:β-淀粉样蛋白病理可促使非常早期的AD出现淡漠和焦虑症状,但很大程度上与认知改变无关。β-淀粉样蛋白对淡漠的影响仅部分通过认知减退介导。总的来说,这些发现强调了某些神经精神症状是AD的早期临床表现。
原文链接:
https://doi.org/10.1016/j.biopsych.2022.01.012
Johansson M, Stomrud E, Johansson PM,et al.Biol Psychiatry. 2022 Jan 31:S0006-3223(22)00053-1.
解读人:潘晓东 教授
福建医科大学附属协和医院神经内科主任医师、教授、博士生导师。福建省老年医学研究所副所长。
福建省康复医学会认知障碍疾病康复专业委员会主任委员、福建省免疫学会免疫与转化医学专业委员会副主任委员、中华医学会神经病学分会痴呆与认知障碍学组秘书、中国神经科学学会神经变性分会委员、中华医学会神经病学分会神经心理学和行为神经病学组委员、中国老年医学学会认知障碍分会常务委员、中华医学会神经病学分会青年委员。

文献解读
2022年1月,隆德大学临床科学系的Maurits Johansson博士在著名期刊Biological Psychiatry(《生物精神病学》)上发表了题为“Development of apathy, anxiety, and depression in cognitively unimpaired older adults: effects of Alzheimer’s disease pathology and cognitive decline”(《 阿尔茨海默病病理和认知减退对无认知损害的老年人淡漠、焦虑和抑郁症状进展的影响》)的研究,研究分析了阿尔茨海默病(AD)病理、白质病变(WML)和认知障碍生物标志物如何潜在影响认知功能未受损(CU)老年人的淡漠、焦虑和抑郁症状的发展,并测试了认知变化是否介导AD病理对NPS纵向发展的影响。
AD的主要病理特征包括脑淀粉样蛋白-β (Aβ)斑块、tau蛋白过度磷酸化形成的神经原纤维缠结。AD临床表现包括认知功能障碍和神经精神症状如淡漠、抑郁和焦虑(NPS)。尽管根据美国国立老化研究所和阿尔茨海默协会的AD标准没有强调NPS,但众所周知,NPS发生频率和严重程度随认知功能的减退而逐渐上升,提示NPS和认知缺陷可以并行发展,NPS可能视为早期表现。横断面研究早期疾病阶段的AD证实了AD病理与NPS之间存在关联。NPS是将来认知能力下降和AD临床前痴呆的预测因子。同时,轻度行为障碍这一新概念强调了NPS可以发生在神经变性疾病的轻度认知障碍(MCI)之前、与之同时或是之后。然而,只有极少数研究测试了神经病理改变和认知对NPS发展的影响。AD的病理、认知和NPS之间确切的时间和因果关系尚不清楚。该研究探讨了AD的病理、WML和认知障碍的生物标志物如何潜在影响认知功能未受损(CU)老年人的NPS症状的发展,测试了认知变化是否介导大脑病理对纵向NPS的影响。结果发现,早期的Aβ病理可能是CU老年人淡漠和焦虑发生和进展背后的重要驱动因素。随时间推移,Aβ对淡漠和焦虑的轨迹产生了微弱或适度的影响,但与认知无关。纵向研究发现焦虑和认知能力下降仅在趋势水平上相关,认知变化仅部分介导Aβ对淡漠的影响。因此Aβ病理可能直接影响淡漠,且在一定程度上独立于认知功能变化。
AD病理对于纵向神经精神症状的影响
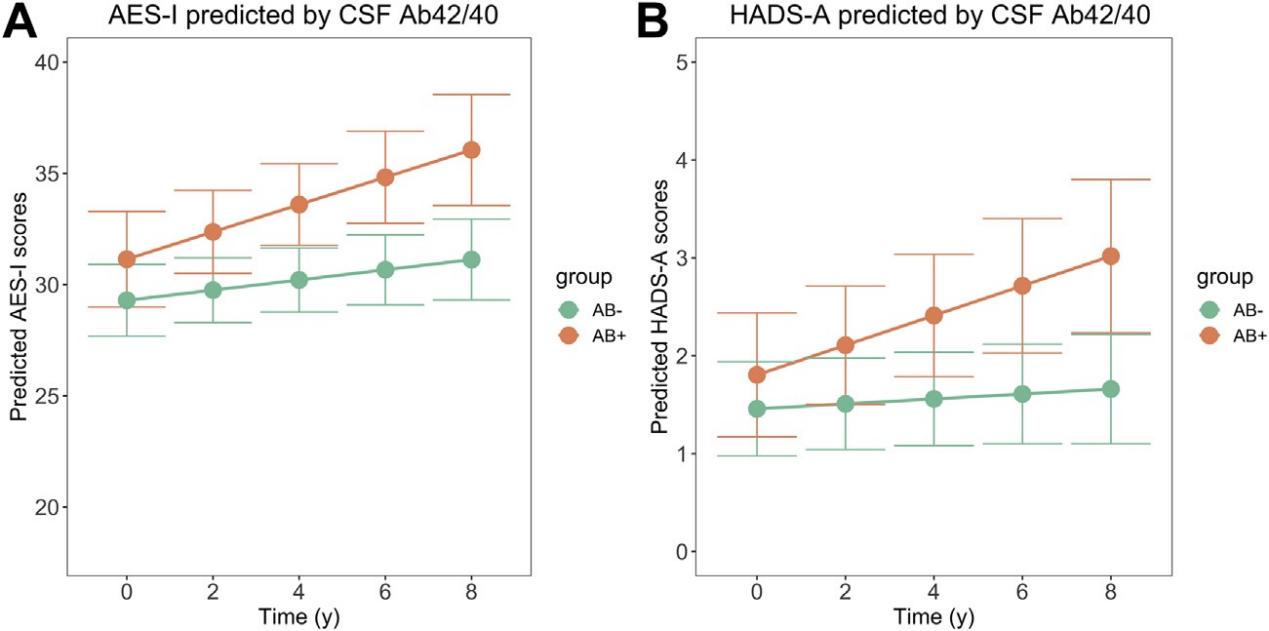
该研究测试了随时间推移,基线病理学和纵向NPS症状之间的关联(表1),生物学标志物主要包括Aβ、tau、神经变性以及WML,NPS主要包括淡漠、焦虑以及抑郁。脑脊液Aβ42/40较低或血浆磷酸化tau高的受试者,其纵向AES-I评分增加越多;脑脊液Aβ42/40较低;或是脑脊液NfL更高的受试者,其纵向HADS-A评分也更高;WML体积大,其AES-S纵向评分更高。多重校正后,仅CSF Aβ42/40随时间推移对AES-I和HADS-A的影响仍然显著。表1显示Aβ阴性与Aβ阳性的NPS关联研究,表明病理改变程度最高的患者NPS评分增长最快。
Aβ与纵向NPS之间的联系:
早期的Aβ病理出现可能是CU老年人淡漠和焦虑的重要驱动因素。Aβ阳性的受试者得分增加,表明Aβ病理表现在某种程度上可能与受试者随后的淡漠发展相关。同时研究显示Aβ病理表现随时间变化与自评焦虑量表得分的发展存在一定联系,而其与抑郁评分之间的联系尚未发现。
认知和认知每年的改变对纵向神经精神症状变化的影响
该实验测试了基线认知或认知每年的改变随时间变化与纵向NPS评分之间的相关性(表2)。结果显示样本中认知状态越差,NPS发生的频率和严重程度越高。该研究发现,纵向认知测试表现对纵向淡漠有很强的效应。有趣的是,淡漠和认知每年的改变之间的联系比病理之间的联系更强。因此,那些因病理出现临床症状的患者会同时表现认知缺陷和NPS。进一步研究表明,焦虑的上升轨迹与改良版临床前阿尔茨海默病认知复合量表5(mPACC5)每年的改变有关。与淡漠相比,纵向焦虑似乎与认知能力下降的关系更小(表2)。
认知减退是否介导了AD病理和NPS之间的相关性
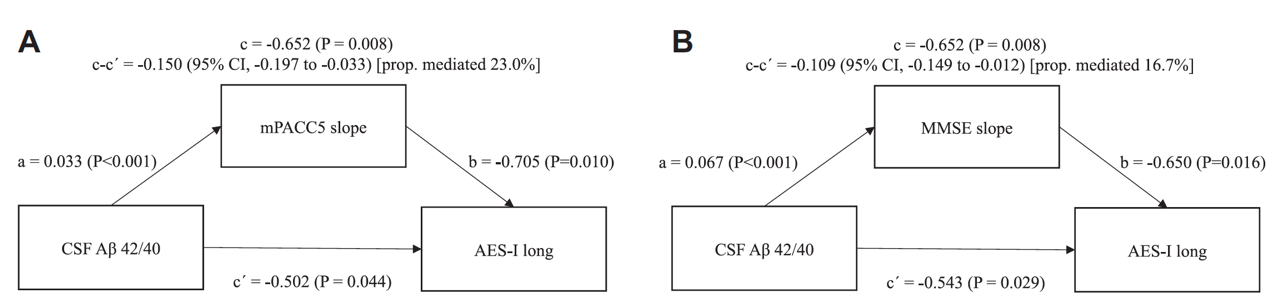
该研究测试了神经病理和纵向NPS之间的关联是否通过每年认知功能的改变来介导。基线CSF Aβ42/40与时间纵向AES-I相互作用的相关部分由mPACC5每年的改变介导,介导率为23%(图1A)。在控制mPACC5每年的改变后,CSF Aβ42/40随时间推移对纵向AES-I的影响仍然显著,表明了Aβ的直接作用以及其且独立于认知功能变化。使用MMSE也得到了类似结果(图1B)。
该研究为我们阐释了纵向NPS与AD相关病理、WML和认知之间的关系,探究了神经病理学和认知对NPS发展的影响,有助于临床早期识别和发现AD的非认知症状,对于AD的诊断和治疗靶点具有重要意义。
(图据Biological & Psychiatry)
图1. 认知评估以mPACC5作为神经病理学和纵向神经精神症状之间关系的统计中介。起始认知未受损参与者的神经病理学、认知和纵向神经精神症状之间关系的中介分析。仅使用初步分析中显示纵向神经精神症状、基线神经病理学(Aβ42/ 40)和认知斜率(mPACC5和MMSE)之间存在显著AES-I相关性的回归模型。使用线性混合效应模型获得了基线CSF Aβ42/ 40对AES-I进展的直接影响(c)。用mPACC5(A)或MMSE(B)测量的认知斜率的中介效应被指定为c–c’。基线CSF Aβ42/ 40对纵向AES-I的剩余影响被指定为c0。基线CSF Aβ42/ 40对中介mPACC5或MMSE的直接影响被指定为a,并通过线性回归模型获得。中介mPACC5/MMSE对AES-I进展的直接影响被指定为b。模型根据年龄、性别和教育程度进行校正。所有固定和随机效应以及协变量均以零为中心。线性混合效应模型包括随机斜率和截距。中介效应的置信区间(CI)是通过1000次迭代的Bootstrapping算法获得。
mPACC5:改良版临床前阿尔茨海默病认知复合量表5,Aβ:β-淀粉样蛋白,MMSE:简易精神状态检查量表,AES-I:淡漠评估量表-信息员评定版,CSF:脑脊液。
(图据Biological & Psychiatry)
表1. 随时间推移,基线病理学对神经精神症状影响的线性混合效应模型。由线性混合效应模型获得的估计边界均值和均值95%置信区间图(经过多重比较调整后)显示了随时间推移,病理学对纵向神经精神症状的显著影响。将纵向测量的信息员评定版淡漠(图A)(274名参与者)和自评焦虑(图B)(321名参与者)作为因变量输入。时间与Aβ42/ 40比值之间的相互作用被输入为以零为中心的固定效应。模型根据年龄、性别和教育程度进行了校正,包括随机斜率和截距。参与者以混合模型获得的脑脊液(CSF)Aβ 42/ 40=0.066为切点进行分组。
Aβ:β-淀粉样蛋白,AES-I:淡漠评估量表-信息员评定版,HADS-A:医院焦虑抑郁量表-焦虑。

(图据Biological & Psychiatry)
表2.纵向认知对纵向神经精神测量影响的线性混合效应模型。通过估计边界均值和均值的95%置信区间图(多重比较调整后)显示纵向认知对纵向神经精神症状的显著影响。在线性混合效应模型中,纵向神经精神症状测量的淡漠(由纵向mPACC5测量的纵向AES-S【n=333】,由纵向mPACC5测量的纵向AES-I【n=300】。时间和mPACC5斜率(每年变化)之间的相互作用在单独的模型中输入为固定效应。参与者根据固定效应变量(T1、T2、T3[数字越高,认知缺陷越大])的三分位数进行分组。所有模型都根据年龄、性别和教育程度进行了校正,并包括随机斜率和截距。
mPACC5:改良版临床前阿尔茨海默病认知复合量表5,AES-S:淡漠评估量表-自评版,AES-I:淡漠评估量表-信息员评定版。
(表据Biological & Psychiatry)
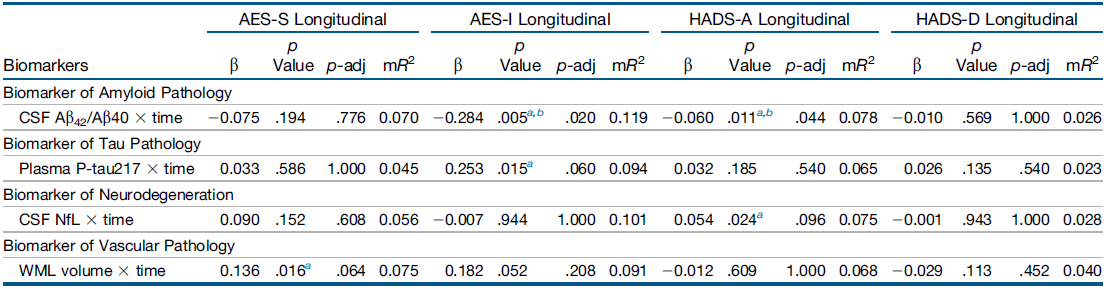
表3 基线病理学标志物随时间推移与纵向神经精神症状之间的关联
用于研究CU参与者随时间推移神经病理学标志物对NPS进展影响的线性混合效应模型(表3)。在单独的模型中,将淡漠、焦虑和抑郁症状的纵向NPS测量作为因变量输入。基线时测量的标志物被逐一输入为与时间相互作用的固定效应(标志物x时间)。固定效应以零为中心。所有模型都根据年龄、性别和教育程度进行了校正,并包括随机斜率和截距。显著性阈值设置为p<0.050。对每个因变量分段进行Bonferroni校正。
总体而言,35名参与者缺乏Aβ42/ 40和NfL的CSF数据,36名参与者缺乏血浆P-tau217数据,11名参与者缺乏WML体积数据。
Aβ:β-淀粉样蛋白,AES-I:淡漠评估量表-信息员评定版,AES-S:淡漠评估量表-自评版,CSF:脑脊液,CU:认知功能未受损,HADS-A:医院焦虑抑郁量表-焦虑,HADS-D:医院焦虑抑郁量表-抑郁,MMSE:简易精神状态检查量表,mPACC5:改良版临床前阿尔茨海默病认知复合量表,mR2:边界R2,NfL:神经丝轻链,NPSs:神经精神症状,p-adj:经多重比较校正的p值,P-tau:磷酸化tau,WML:白质病变。
(表据Biological & Psychiatry)
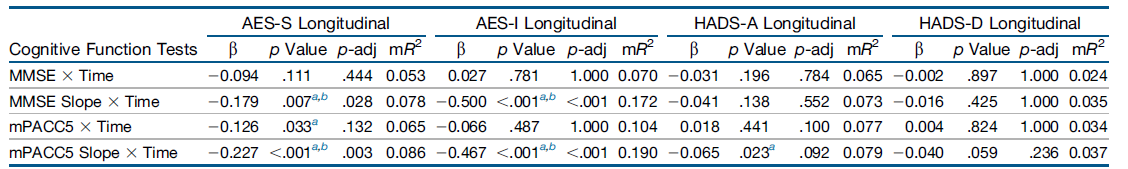
表4. 认知随时间推移与纵向神经精神症状之间的关联。
用于研究CU参与者随时间推移认知对NPS进展影响的线性混合效应模型(表4)。在不同的模型中,将淡漠、焦虑和抑郁症状的纵向NPS测量作为因变量输入。基线时测量的认知值,包括认知斜率,被逐一输入为与时间相互作用的固定效应(认知x时间)。固定效应以零为中心。MMSE和mPACC5得分的个人年变化(斜率)使用个人线性回归模型生成,其中纵向MMSE和mPACC5由时间预测。所有模型都根据年龄、性别和教育程度进行了校正,并包括随机斜率和截距。显著性阈值设置为p<0.050。对每个因变量分段进行Bonferroni校正。
AES-I:淡漠评估量表-信息员评定版,AES-S:淡漠评估量表-自评版,CU:认知功能未受损,HADS-A:医院焦虑抑郁量表-焦虑,HADS-D:医院焦虑抑郁量表-抑郁,MMSE:简易精神状态检查量表,mPACC5:改良版临床前阿尔茨海默病认知复合量表5,mR2:边界R2,NPSs:神经精神症状,p-adj:经多重比较校正的p值,P-tau:磷酸化tau。