多发性硬化脑脊液和血浆中的细菌神经毒性代谢物
摘要译文
对神经和精神疾病患者肠道菌群失调的鉴定提示了脑-肠交流的重要性,然而,关于如何介导脑-肠交流的机制问题仍未解决。我们先前报道接受富马酸二甲酯(DMF)治疗的复发缓解型多发性硬化患者(RRMS)的肠道微生物群明显减少,因此,研究这些患者的血浆和脑脊液(CSF)样本的成分可能有助于识别微生物衍生的代谢物。我们采用一种功能性异种试验将培养的大鼠神经元暴露于收集的DMF治疗前后多发性硬化(MS)患者的CSF样本中,以评估神经毒性,然后对血浆和CSF样本进行代谢组学分析,以确定不同丰度的代谢物。加权相关性网络分析使我们能够识别血浆和CSF样本中存在的代谢产物组,其丰度与CSF的神经毒性潜力密切相关。该分析鉴定出MS患者存在细菌来源的苯酚和吲哚类代谢物(例如,硫酸对甲酚、硫酸吲哚酚和N-苯乙酰谷氨酰胺),并具有潜在神经毒性,而且经治疗后上述代谢物的水平明显减少。培养的神经元长期暴露于这些代谢物会损害其放电频率并诱导轴突损伤,这与线粒体功能障碍和氧化应激无关,因此确定了一种新的神经毒性途径。在随访期间,还收集了接受治疗患者的临床、影像学和认知测试指标。仅在接受DMF治疗的RRMS患者中检测到改善的核磁共振成像(MRI)指标、残疾程度和认知功能。已确定细菌来源的代谢物(硫酸对甲酚、硫酸吲哚酚和N-苯乙酰谷氨酰胺)的水平与皮质体积的MRI测量值呈负相关,并与神经丝轻链(一种已确定的神经退行性变生物标志物)水平直接相关。我们的数据表明,色氨酸和苯丙氨酸分解产生的苯酚和吲哚衍生物是微生物衍生的代谢产物,可能介导脑-肠交互过程并诱发MS的神经毒性。
关键词:微生物群;神经退行性变;大脑;代谢
原文链接:
https://doi.org/10.1093/brain/awab320
Achilles Ntranos, Hye-Jin Park, Maureen Wentling, et al. Brain,2021 Dec 11:awab320.

解读人:彭国平 博士
l 浙江大学医学院附属第一医院神经内科,主任医师博士生导师,神经内科副主任
l 中华医学会神经病学分会痴呆与认知障碍学组委员,中国医疗保健国际交流促进会神经病学分会委员,中国医师协会神经内科医师分会青年委员,中国老年医学学会认知障碍分会常务委员

解读人:刘萍 博士
l 浙江大学医学院附属第一医院神经内科,副主任医师
l 中国老年医学学会认知障碍分会第一届委员会青年委员会委员,中国微循环学会神经变性病专业委员会第二届青年委员会委员,浙江省医学会神经病学分会认知与神经心理学组秘书,浙江省康复医学会第二届青年理事会理事
研究解读
2021年12月,美国纽约市立大学研究生中心和西奈山伊坎医学院等机构的科学家们在临床神经学领域的国际顶级期刊Brain上发表了一篇题为“Bacterial neurotoxic metabolites in multiple sclerosis cerebrospinal fluid and plasma”(《多发性硬化脑脊液和血浆中的细菌神经毒性代谢物》)的研究报告,发现微生物代谢产物苯酚和吲哚衍生物可能介导脑-肠交互过程并诱发多发性硬化(MS)的神经毒性。
MS是一种中枢神经系统自身免疫性脱髓鞘疾病,由遗传和环境因素共同导致,其确切发病机制尚不明确。肠道菌群作为一种重要的环境因素,通过一系列直接和间接途径参与包括MS在内的多种神经精神疾病的发生发展过程。对肠道菌群的研究探索将有助于厘清MS遗传与环境相关的发病机制,有助于MS的诊断和干预治疗。既往已经有研究表明MS患者肠道菌群较正常健康人群发生改变,该研究团队前期研究发现富马酸二甲酯(DMF)治疗的复发缓解型多发性硬化症(RRMS)患者肠道菌群丰度显著降低。
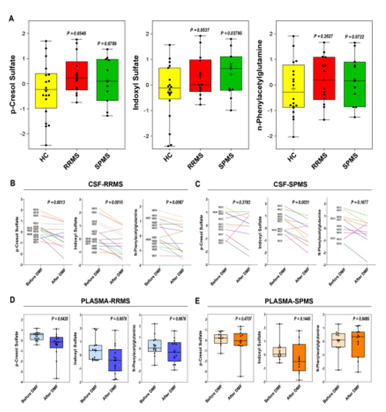
在本研究中,研究者对接受DMF治疗的MS患者脑脊液和血浆样本进行了代谢组学分析,发现三种肠道菌群来源代谢产物,即苯酚代谢产物—硫酸对甲酚和N-苯乙酰谷氨酰胺以及吲哚类代谢物——硫酸吲哚酚的表达水平均显著高于健康对照组(图1)。并且,RRMS患者经DMF治疗后,脑脊液和血浆中的上述代谢物显著降低,而在继发进展型多发性硬化症(SPMS)患者中的这种改变却不明显(图1)。提示肠道菌群来源的上述几种代谢物可能通过血脑屏障进入中枢发挥神经毒性作用,促使RRMS的发生和发展。
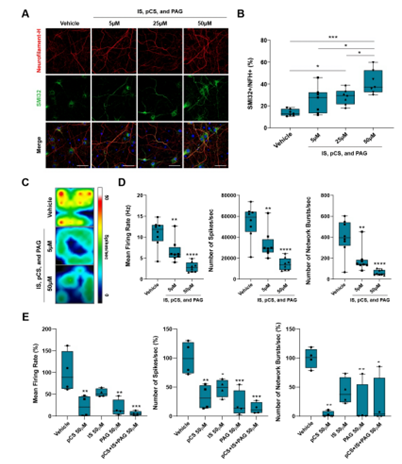
该研究团队进一步对上述三种产物的神经毒性作用进行了验证。通过细胞实验,将培养的神经元暴露于含有上述三种代谢产物的溶液中,研究者发现这些代谢产物能够显著减少神经元的放电频率、诱导轴突损伤,并呈浓度依赖性(图2),且这种神经毒性作用与线粒体功能障碍和氧化应激无关。
最后,该研究团队分析了三种神经毒性代谢物与MS患者脑脊液中神经退行性变生物标志物(神经丝轻链蛋白(NFL))、临床转归及脑皮层体积的相关性。结果发现这些代谢物与脑脊液NFL浓度显著正相关,这也进一步佐证了硫酸对甲酚、N-苯乙酰谷氨酰胺和硫酸吲哚酚的神经毒性作用。对MS患者随访研究发现,在接受DMF治疗的RRMS患者中,上述神经毒性物质的水平与核磁共振成像(MRI)测量得出的大脑皮质体积呈负相关。
综上,该研究的结果表明,来自肠道菌群的色氨酸和苯丙氨酸分解代谢的苯酚和吲哚衍生物可能介导宿主的脑肠沟通,并诱发对MS的神经毒性。DMF治疗MS的机制之一可能是通过重塑MS患者的肠道微生物,进而降低了机体内肠道菌群来源的神经毒性代谢产物水平,减轻其中枢神经毒性作用。这一研究不仅加深了对脑肠交互在MS发生进展过程中所扮演角色的理解,还为开发新的MS疗法提供了一个潜在的代谢靶点。
(图据Brain)
图1. RRMS脑脊液中的神经毒性代谢物水平高于SPMS。A图显示RRMS、SPMS和HC组脑脊液中硫酸对甲酚、硫酸吲哚酚和N-苯乙酰谷氨酰胺标准化后的水平,与对照组相比,MS患者的每种代谢物的丰度更高。B-C图RRMS和SPMS患者基线(每条线代表基线检查时)(DMF治疗前)和DMF治疗6个月后(DMF治疗后)脑脊液样本中代谢物相对丰度的配对比较,结果显示RRMS患者的硫酸对甲酚、硫酸吲哚酚和N-苯乙酰谷氨酰胺的相对丰度在DMF治疗后显著减低,但SPMS患者脑脊液中上述的神经毒性代谢物丰度没有降低。D-E图同样,DMF治疗后,RRMS血浆中的上述神经毒性代谢产物相对丰度降低,而SPMS则没有显著变化。A、D和E图的箱图中的线代表四分位数(第25、第50、第75),而虚线标记数据的最小值和最大值。通过控制年龄的线性回归(A图)或配对学生t检验(B-E图)计算统计学显著性。
(图据Brain)
图2. 已鉴定的细菌代谢物直接诱导轴突损伤和神经元功能障碍。A图 慢性暴露于不同浓度三种细菌代谢物(IS:硫酸吲哚酚,pCS:硫酸对甲酚,PAG:N-苯乙酰谷氨酰胺),培养18天后的轴突显像(绿色,SMI32:轴突标记物)和神经丝重链显像(红色)以及共聚焦显像;B图 剂量依赖性轴突损伤,以与SMI32共染色的NFH+神经元突起的百分比表示。C图 使用MEA法测量神经元自发电活动的伪彩图(神经元保存在常规培养基中,补充有生理盐水或指定浓度的细菌代谢物),红色代表神经元高的电活动,蓝色代表神经元低的电活动。D图 三种细菌代谢产物的混合液显著降低了神经元的自发活性(通过计算平均放电率、每秒棘波数和网络爆发数来测量)。E图 每种代谢物的神经毒性作用都非常显著但有各自的不同,且其混合物也呈现出协同毒性作用(在平均放电率和每秒棘波数方面)。B、D和E图的箱图中的线代表四分位数(第25、第50、第75),而须线标记数据的最小值和最大值。通过单因素方差分析和Tukey事后检验评估统计学显著性。* = P <0.05,** = P <0.01,*** = P <0.001,**** = P <0.0001。比例尺:50μm。