帕金森病与肠道:发病机制和临床相关性的新见解
摘要
经典观点为帕金森病(PD)是一种由于黑质致密部多巴胺能神经元丢失而导致的运动障碍。然而,多项研究描述了前驱非运动功能障碍会影响后续发展为帕金森病的患者的生活质量。这些前驱功能障碍包括多种胃肠动力障碍,如吞咽困难、胃排空延迟和慢性便秘。PD的组织学标志物-路易体和神经轴突中错误折叠的α-突触核蛋白聚集体于临床诊断之前在肠道神经系统中被检测到,这表明胃肠道及其与中枢神经系统连接的神经(迷走神经)可能在PD的病因学中起重要作用。这篇综述提供了关于 PD 发病机制的新见解,包括肠-脑的α-突触核蛋白运输以及新发现的黑质-迷走神经通路,强调了环境病原体如何通过肠道迷走神经进入中枢神经系统并最终诱导或加速PD进程,评价了各种环境神经毒性物质的致病潜力和PD实验动物模型的适用性和转化潜力。最后简要讨论了帕金森病累及胃肠道的临床表现和药物治疗。
原文链接:
https://www.nature.com/articles/s41575-020-0339-z
Travagli RA, Browning KN, Camilleri M.Nature Reviews Gastroenterology & Hepatology. 2020;17(11):673-685.
解读人:叶芳教授 四川省人民医院神经内科副主任医师
文献解读:
2020年11月,Travagli教授及其团队在国际知名期刊Nature Reviews Gastroenterology & Hepatology上发表综述文章《帕金森病与肠道: 发病机制和临床相关性的新见解》。这篇综述从神经通路、动物研究、临床表现等方面综合阐述了PD发病机制与肠道功能的新见解,重点介绍环境病原体如何通过肠道迷走神经进入中枢神经系统并最终诱导或加速PD进程;并评价各种环境神经毒性物质的致病潜力和PD实验动物模型的适用性和转化潜力;最后简要讨论了帕金森病累及胃肠道的临床表现和药物治疗。
在发病机制方面,经典观点认为帕金森病(PD)是一种由于黑质致密部多巴胺能神经元丢失而导致的运动障碍类疾病。对PD患者的尸检证实其典型病生理改变为异常折叠的α-突触核蛋白于胞内聚集而形成的路易小体(Lewy bodies)与路易突起(Lewy neurites)。异常折叠的α-突触核蛋白可导致突触功能障碍;且尸检及动物研究证实其亦具有类朊病毒的迁移属性,可在无/少髓鞘的投射神经元等易感神经元突触间跳跃传播。临床研究也发现α-突触核蛋白病变可在周围神经和中枢神经系统的连接区域扩散。除了黑质致密部(SNpc),在迷走神经背侧运动核(DMV)、蓝斑、肠道神经系统(ENS)的外周神经及颌下腺等,均可发现路易小体。这些发现可以解释PD的非运动性前驱症状,包括多种胃肠动力障碍,如吞咽困难、胃排空延迟和慢性便秘。在大量研究基础上,Braak及其团队提出:致病原的摄入、吸收和运输可以导致异常α-突触核蛋白在ENS的积累,并通过迷走神经运输到DMV、SNpc和高级皮层。而且,研究证实α-突触核蛋白可从DMV向SNpc快速扩散,通过激活DMV和A2儿茶酚胺能区域神经元的多巴胺受体,可兴奋SNpc神经细胞并提高胃张力及动力,且切除迷走神经或选择性破坏多巴胺能神经元可抑制这种作用。因此,迷走神经可能作为胃肠道与中枢神经系统的连接神经,在PD的发病机制中起重要作用(图1,2)。
文章还介绍了PD相关胃肠功能紊乱的研究进展及PD实验动物模型的适用性和转化潜力。常用的急性中毒诱导的PD动物模型很难模拟PD的慢性病程,难以用于研究胃肠功能紊乱等非运动症状。研究发现少量多次暴露于农药或杀虫剂可更好的模拟PD的病程及研究PD相关胃肠功能紊乱的发病机制,这些动物模型研究证实致病原(农药、杀虫剂)可通过肠道吸收,并通过ENS和迷走神经通路影响中枢神经系统功能。神经毒素MPTP、6-OHDA可通过破坏实验动物的中枢神经系统导致PD的运动症状,也可导致PD相关的胃肠功能紊乱,说明PD的发病机制不仅包括外源性毒物,也可能包括中枢源性病因。研究发现小鼠肠内注入大剂量预制α-突触核蛋白可导致胃肠功能紊乱及DMV的α-突触核蛋白水平升高,迷走神经切除的小鼠中不能观察到此现象。转基因PD小鼠及一些多重机制诱导PD的动物模型中亦可观察到胃肠功能紊乱及相关病生理改变。
在PD相关胃肠功能的临床症状方面,文章着重介绍了流涎、胃排空延迟和肠动力不足、便秘及大便失禁等症状及发生率和潜在机制,并提出肠道菌群对PD的发病及治疗反应存在重要意义:PD患者存在显著的肠道菌群紊乱;在无菌小鼠肠道内置入PD患者的粪便菌群,可导致运动症状的恶化、肠道运动紊乱及α-突触核蛋白病变;PD的治疗药物可能进一步延迟胃排空,影响药物的吸收和作用,从而影响其治疗剂量和疗效。角鲨胺制剂可能具有调节和保护PD胃肠功能的作用。
总的来说,PD的非运动症状(尤其是胃肠道功能障碍)的特点和机制尚未得到充分的研究和明确。科研方面面临的主要挑战就是需要可准确模拟PD病理生理改变的实验模型,既可用来研究症状学相关的神经环路,又可研究神经退行性病变的细胞分子机制。临床方面,亟需研发对PD具有疾病修饰作用以及可改善其非运动症状的药物。

(图据Nature Reviews Gastroenterolgy & Hepatology)
图1. PD基底节及脑干神经连接简图。粗体或虚线分别表示突触输入的增加或减少。PD主要由黑质致密部(SNpc)多巴胺能神经元的变性和死亡引起。还原性多巴胺能神经元从SNpc到背侧纹状体(即尾状核和壳核)的输入减轻了间接通路的抑制,并降低了直接通路的活性,从而导致丘脑的整体抑制和运动皮层的兴奋性降低。虽然尚未深入研究,但新发现的黑质-迷走神经通路影响上消化道的迷走神经功能,并可能参与PD的前驱胃肠道症状。DA1-like:多巴胺D1样受体;DA2-like:多巴胺D2样受体;DMV:迷走神经背侧运动核;ENS:肠神经系统;GPi:苍白球内侧部;SNr:黑质网状部。
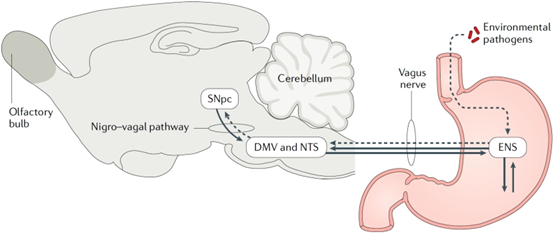
(图据Nature Reviews Gastroenterolgy & Hepatology)
图2. 肠-脑环路及α-突触核蛋白体的可能扩散路径。根据Braak的假设(虚线),吞咽唾液中的鼻腔分泌物会导致环境病原体进入胃肠道内壁并进入肌间神经元,从而触发肠神经系统(ENS)和嗅球中α-突触核蛋白包涵体的形成。α-突触核蛋白病通过迷走神经逆行上升至脑干迷走神经背侧运动核(DMV)的神经元,并通过新发现的黑质-迷走神经通路到达黑质致密部(SNpc),在那里诱导多巴胺能神经元变性和帕金森病的典型特征。在大鼠模型中,连接肠道和SNpc的神经通路被摄入的环境病原体改变,从而导致α-突触核蛋白错误折叠、帕金森病和胃肠功能障碍。NTS:孤束核。