甘露特钠治疗阿尔茨海默病的II期随机对照试验
摘要译文
背景:甘露特钠(GV-971)是一种从海洋褐藻提取的寡糖,作为一种新药其可能会改善阿尔茨海默病(Alzheimer’s disease,AD)患者的认知功能。
方法:本研究为2011年10月24日~2013年7月10日针对中国AD患者开展的一项为期24周的多中心、随机、双盲、安慰剂平行对照临床试验。研究包括4周的筛选/洗脱期,继以为期24周的治疗期。在治疗期,受试者按1:1:1比例随机接受GV-971 900 mg、600mg或安慰剂治疗。主要终点是以阿尔茨海默病评定量表-12项认知分量表(ADAS-cog12)评分为指标的认知功能改善情况,评估基线至24周时的ADAS-cog12变化。次要疗效结局包括:24周时的临床医生访视的印象变化量表(CIBIC+)、阿尔茨海默病-日常生活活动量表(ADCS-ADL)和神经精神量表(NPI)与基线时的比较。在亚组分析中,通过氟-脱氧葡萄糖-正电子发射计算机断层显像评估大脑糖代谢的变化。
结果: 与安慰剂组相比(n = 83,改变值=-1.45),GV-971 600 mg组(n = 76)的ADAS-cog12 评分改变值为-1.39(p = 0.89),GV-971 900 mg组(n = 83)的改变值为-2.58(p = 0.30)。依据CIBIC+评估疗效,发现GV-971 900 mg组的疗效响应率显著高于安慰剂组(92.77% vs.79.52%,p < 0.05)。亚组分析提示GV-971 900 mg组左侧楔前叶、右侧扣带回后部、双侧海马、双侧眶额回的糖代谢率下降较安慰剂组慢(未校正p = 0.05)。安慰剂组、GV-971 600 mg组及900 mg组中治疗相关的不良事件率分别为5.9%, 14.3%,和3.5%。
结论: GV-971安全且耐受性良好。GV-971 900 mg剂量作为III期临床试验用量。
试验注册: ClinicalTrials.gov, NCT01453569. 2011年10月18日注册。
关键词: 甘露特钠,疗效,安全性,阿尔茨海默病,临床试验。
原文链接:https://alzres.biomedcentral.com/articles/10.1186/s13195-020-00678-3
Wang T, Kuang W, Chen W, et al. Alzheimers Res Ther. 2020 Sep 14;12(1):110.
研究解读
阿尔茨海默病是老年人中最常见的痴呆类型。根据《2018年世界阿尔茨海默病报告》,目前全球范围内约有5,000万人罹患痴呆,其中三分之二的人患有AD。中国有超过1000万的AD患者,预计到2050年,这个数字将会超过4000万。AD也成为老年人致残和致死的主要原因之一。而目前临床只有两种类型治疗药物,胆碱酯酶抑制剂和N⁃甲基⁃D⁃天冬氨酸受体拮抗剂,但只能改善症状,并不能改变疾病进程。目前只有一款新药于2019年底在中国上市,这就是绿谷制药、上海药物所、中国海洋大学联合开发的甘露特钠胶囊(GV-971),下面简单回顾一下其II期临床研究。
2020年9月,上海市精神卫生中心肖世富教授、王涛教授及上海药物研究所耿美玉教授共同通讯在国际知名期刊Alzheimer's Research & Therapy(《阿尔茨海默病研究与治疗》)上发表了甘露特钠胶囊的II期研究结果。一般情况下,Ⅱ期临床试验是新药首次应用于目标患者,以观察新药的初步有效性、安全性数据。其目的是初步评价药物对目标适应症患者的治疗作用和安全性,也包括为III期临床试验研究设计和给药剂量、疗程等确定提供依据。该项II期研究旨在初步评估甘露特钠(GV-971)对轻-中度AD患者的疗效及安全性。GV-971是一种线性、酸性寡糖混合物,最初来源于海藻。非临床研究显示,GV-971通过肠道菌群重建和缓解脑内Th1和M1型小胶质细胞介导的神经炎症靶向肠脑轴;此外,GV-971还可直接与Aβ的多个亚区结合,抑制Aβ纤维形成,并促进小胶质细胞介导的Aβ体外吞噬作用,从而逆转认知损害。该II期研究纳入50- 85岁、小学及以上教育程度且经MRI或CT确诊的轻中度AD患者(MMSE 10-24分),分为三组(GV971 600mg/天,900mg/天或安慰剂组),口服给药,持续24周。主要研究终点为基线至24周的ADAS-Cog12变化,次要终点包括临床医生访视的印象变化量表(CIBIC+)、阿尔茨海默病-日常生活活动量表(ADCS-ADL)和神经精神量表(NPI)变化。此外,还评估治疗后脑部葡萄糖代谢情况。结果显示,与安慰剂组相比(n = 83,改变值=-1.45),GV-971 600 mg组(n = 76)的ADAS-cog12 评分改变值为-1.39(p = 0.89),GV-971 900 mg组(n = 83)的改变值为-2.58(p = 0.30)。(如图所示)。次要终点CIBIC+,GV-971 900 mg组的疗效有效率显著高于安慰剂组;亚组分析发现在治疗24周后,GV-971 900mg有改善左侧楔前叶、右侧扣带回后部、双侧海马、双侧眶额回脑区葡萄糖代谢水平的趋势(未校正p = 0.05)。而在药物安全性方面,三组不良事件的发生率无显著性差异(如表所示)。
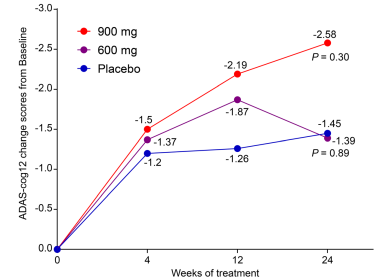
图解:对三组主要终点(ADAS-cog12评分)进行基线至24周的全分析集。p值为与安慰剂组相比,24周相对于基线的变化情况。
(图据Alzheimer's Research & Therapy)

表:各组药物相关不良事件(表据Alzheimer's Research & Therapy)
通过II期临床试验数据梳理和回顾,可以为后序III期临床试验提供剂量及治疗周期的参考。首先,确定了900mg可以作为GV-971 III期临床试验的剂量。其次,在主要疗效指标ADAS-cog12评分方面,经过24周的治疗后,安慰剂组安慰剂效应明显,而GV-971 900mg组出现持续改善的趋势,因此在后期的研究中,应该将治疗周期进一步延长。另外,根据此次的研究结果,可以为后续的III期临床试验提供统计学上的参考,对样本量和效应值进行估算。
后续,申办方以900mg剂量作为III期临床试验的用量,延长给药周期至9个月,且对临床试验设计与质控进行优化,进一步探讨GV-971的疗效及安全性,最后III期临床试验获得了成功。