甘露特钠II-III期临床研究解读 章节述评
文/于恩彦教授 中国科学院大学附属肿瘤医院主任医师
阿尔茨海默病(Alzheimer’s disease, AD )从发现该病至今,其发病机制仍未明了。β-淀粉样蛋白学说、tau蛋白学说、神经炎症学说、自噬损伤、突触功能障碍/丢失、血管功能障碍、线粒体功能障碍、免疫、代谢、表观遗传、氧化应激等理论是影响较大的学说,但目前基于这些机制药物研发尚未取得突破。近年来,一些专家学者发现肠道菌群在AD发展过程中发挥作用,同时在临床研究中,也发现在轻度认知功能障碍(MCI)阶段就出现肠道菌群失调,提示肠道菌群失调可能参与AD的发生发展。上海药物研究所耿美玉教授团队在临床前研究中发现在AD进程中,Aβ沉积及Tau蛋白过度磷酸化会造成肠道菌群稳态失衡,继而触发外周免疫炎症,促使炎性免疫细胞Th1向大脑侵润,引起小胶质细胞活化,导致与AD相关的神经炎症发生,引起认知功能障碍。此外,该研究团队还发现一种新的寡糖药物——甘露特钠(GV-971),可以通过调控脑-肠轴改善AD模型小鼠的认知功能(如图)1。
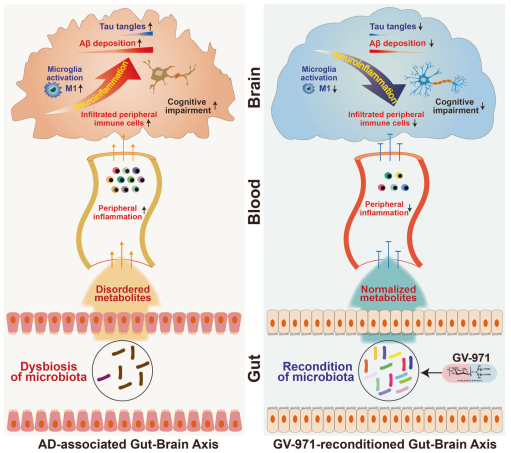
图解:AD进程中的肠-脑轴及干预策略示意图。AD进展过程中,随着Aβ沉积和tau蛋白磷酸化,肠道菌群失调引起代谢紊乱。产生的异常代谢物引起外周炎症,与大脑中M1型小胶质细胞交互作用的免疫细胞向脑内浸润增加,导致病理性神经炎症和认知功能障碍(左图)。口服GV-971可以重塑肠道菌群,纠正代谢紊乱,减少外周免疫细胞向大脑浸润,缓解神经炎症,减少Aβ沉积和tau磷酸化,最终改善认知功能。
(图据Cell Research)
基于该药物临床前研究的证据,该研发团队开展了进一步临床试验,验证GV-971治疗AD的疗效及安全性。2020年9月,上海市精神卫生中心肖世富教授、王涛教授及上海药物研究所耿美玉教授共同通讯发表了GV-971治疗轻-中度AD患者的II期临床试验结果,该研究为2011年10月24日~2013年7月10日进行的针对中国轻-中度AD患者的一项为期24周的多中心、随机、双盲、安慰剂平行对照临床试验,旨在探索不同剂量药物的疗效及安全性。研究发现GV-971 900mg/天有改善认知功能的趋势,确定了III期临床试验的药物剂量(900mg/天),也证实了该药安全性良好2。次年,III期临床试验也随即开展,于2014年3月~2018年6月纳入中国50~85岁轻-中度AD患者,进一步评估GV-971 900mg/天的有效性及安全性。2021年3月,上海市精神卫生中心肖世富教授、北京协和医院张振馨教授及上海药物研究所耿美玉教授共同通讯发表了GV-971 III期临床试验结果,结果表明GV-971 900mg/天可以从第4周开始显著改善轻-中度AD患者的认知功能,持续至第36周,并且安全性良好。并且对中度偏重AD患者的疗效尤其显著3。目前该药于2019年经CFDA有条件批准在中国上市,给AD患者带来了新的治疗选择,也为AD领域内药物研发提供了新的思路。据悉,目前该研发团队正在进行国际多中心Ⅲ期临床试验,以期全面评估GV-971的疗效及安全性。同时,还将AD生物标志物、肠道菌群及神经炎症等指标纳入研究结局,旨在验证GV-971对AD的疾病修饰作用。
至今,我国已上市的改善认知功能的药物非常有限,仅有胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂。近年来,科学家们对AD的病理生理过程及遗传学基础研究已经有了较大进展,经典的Aβ级联假说已经被修正;然而,目前针对AD的药物研发基本上是“一药一靶”的格局,研发成功率较低4。另一方面,近年来,新的AD干预靶点例如微生物-肠-脑轴相关机制研究等亦获得了较大的突破,肠道菌群失调可能通过多种途径参与AD的病理进程5。研究表明,AD患者的肠道菌群与正常人相比发生了功能变化6,并且当患者从MCI进展至AD的过程中,肠道菌群失调逐渐加重7。基于调节肠-脑轴的药物—甘露特钠(GV-971),也在中国III期临床研究中证实了可改善轻-中度AD患者的认知功能。此外,降糖药物GLP-1类似物索马鲁肽也在开展治疗AD的III期临床研究项目。因此,给我们带来的启示是,AD作为一种慢性复杂性神经退行性疾病,其药物的研发是否可以考虑跳出“一药一靶”的思维框架,寻找新的治疗靶点或系统,多靶点或多系统地治疗AD。我们期待更多不同类型的创新药物上市,解决广大AD患者的临床需求。
参考文献
1. Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer's disease progression. Cell Res.2019;29(10):787-803.
2. Wang T, Kuang W, Chen W, et al. A phase II randomized trial of sodium oligomannate in Alzheimer's dementia. Alzheimers Res Ther. 2020;12(1):110.
3. Xiao S, Chan P, Wang T, et al. A 36-week multicenter, randomized, double-blind, placebo-controlled, parallel-group, phase 3 clinical trial of sodium oligomannate for mild-to-moderate Alzheimer's dementia. Alzheimers Res Ther. 2021;13(1):62.
4. Scheltens P, De Strooper B, Kivipelto M, et al. Alzheimer's disease. The Lancet. 2021;397(10284):1577-90.
5. Osorio C, Kanukuntla T, Diaz E, et al. The Post-amyloid Era in Alzheimer's Disease: Trust Your Gut Feeling. Front Aging Neurosci. 2019 Jun 26;11:143.
6. Zhuang ZQ, Shen LL, Li WW, et al. Gut Microbiota is Altered in Patients with Alzheimer's Disease. J Alzheimers Dis. 2018;63(4):1337-1346.
7. Guo M, Peng J, Huang X, et al. Gut Microbiome Features of Chinese Patients Newly Diagnosed with Alzheimer's Disease or Mild Cognitive Impairment. J Alzheimers Dis. 2021;80(1):299-310.