肠道菌群通过脂多糖及丁酸盐与卒中后认知障碍因果相关
Gut microbiota is causally associated with poststroke cognitive impairment through lipopolysaccharide and butyrate
肠道菌群通过脂多糖及丁酸盐与卒中后认知障碍因果相关
摘要译文
背景:卒中后认知障碍(PSCI)在脑卒中患者中普遍存在,然而PSCI的病因仍不清楚。以往研究发现脑卒中可以诱发肠道菌群失调,进而影响脑损伤。因此,本研究的目的是探讨肠道菌群是否参与了PSCI的发病机制。
方法:共计招募83例卒中患者,在卒中发生3个月后通过蒙特利尔认知评估量表(MoCA)评估认知功能,并分析外周炎症因子水平和肠道菌群的组成。此外,本研究将患者的粪便菌群移植给卒中小鼠,研究肠道菌群和PSCI之间的因果关系。通过Morris水迷宫试验评估小鼠的认知功能。
结果:卒中患者中34例为PSCI,49例为非PSCI。与非PSCI患者相比,PSCI患者肠道内肠杆菌科丰度、脂多糖(LPS)和外周炎症标志物的水平显著升高。与接受非PSCI患者菌群的卒中小鼠(nPSCI小鼠)相比,接受PSCI患者菌群的卒中小鼠(PSCI小鼠)的肠杆菌科丰度、肠道Toll样受体-4(TLR4)的表达、循环的LPS、LPS结合蛋白(LBP)和炎性因子的水平均升高,而粪便中丁酸盐水平降低,且肠道破坏和认知障碍更严重,这与PSCI患者结果一致。此外,与nPSCI小鼠相比,本研究在PSCI小鼠中观察到了严重地血脑屏障完整性(BBB)的破坏、小胶质细胞的激活、海马CA1区神经元凋亡和丘脑中Aβ沉积。卒中后腹腔注射LPS引起与PSCI小鼠相似的病理变化,并且通过饮水补充丁酸钠(NaB)可缓解PSCI小鼠的相关病变。
结论:本研究数据首次揭示了肠道菌群和PSCI之间存在的因果关系,并提示这可能是通过炎症相关代谢产物LPS和丁酸盐所介导。
关键词:卒中后认知障碍,脂多糖,粪菌移植,海马区细胞凋亡,β-淀粉样蛋白
解读人 马晓伟 教授
河北医科大学第一医院神经内科主任、主任医师、博士、教授、博士生导师
主持河北省自然基金、河北教育厅、河北省科技民生专项等多项省厅级课题。获河北省科技进步二等奖2项,河北省医学科技奖一等奖1项。
香港中文大学访问学者,首都医科大学宣武医院访问学者

文献解读
2022年4月,南方医科大学南方医院的尹恝团队、吴齐恒团队与南方医科大学珠江医院的何彦团队在Journal of Neuroinflammation上发表了一篇题为“Gut microbiota is causally associated with poststroke cognitive impairment through lipopolysaccharide and butyrate”(肠道菌群通过脂多糖及丁酸盐与卒中后认知障碍因果相关)的研究。该研究不仅明确了卒中后认知障碍(PSCI)患者的肠道菌群特征及外周炎症状态,同时通过粪菌移植(FMT)实验的方法揭示了肠道菌群与PSCI的因果关联及其可能机制,为寻找阿尔茨海默病(AD)的干预靶点及研发新型AD治疗药物提供了理论和实验依据。
此研究共纳入了83例卒中患者(34例PSCI,49例非PSCI),采用16S RNA测序技术对患者入院时及3个月后的粪便标本进行肠道菌群分析,结果显示在非PSCI患者中,肠杆菌科的丰度随着时间的推移而显著下降,而在PSCI患者中,随着时间的推移,肠杆菌科的丰度趋于增加;此外,PSCI患者外周血白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、脂多糖(LPS)、内毒素结合蛋白(LBP)、D-乳酸(DLA)及血沉(ESR)水平均显著高于非PSCI患者,这表明与非PSCI患者相比,PSCI患者处于高炎症反应状态。
为了明确肠道菌群与PSCI发病机制的因果关联,研究者们将PSCI患者及非PSCI患者的粪便菌群分别转移到卒中小鼠中,发现与接受非PSCI患者菌群的小鼠(nPSCI小鼠)相比,接受PSCI患者菌群的小鼠(PSCI小鼠)肠道上皮被破坏,肠杆菌科的丰度、肠道Toll样受体-4(TLR4)的表达、外周血LPS、LBP及IL-6等炎症因子水平显著升高(图1),而粪便中丁酸盐水平则显著降低。此外,nPSCI小鼠的肠屏障及血脑屏障受损、小胶质细胞活化、海马神经元凋亡、丘脑Aβ沉积且认知障碍更严重(图2),这表明肠道菌群在PSCI的发病中发挥着重要作用。
在目前的研究中,我们首次证明了在PSCI中,LPS和丁酸盐作为肠道菌群的代谢产物将肠道和大脑联系了起来。我们给卒中小鼠腹腔注射了LPS,发现小鼠具有了与PSCI小鼠类似的外周LPS水平及病理改变。NaB在维持肠道屏障功能和缓解肠道炎症中具有重要作用,在本研究中,我们发现补充NaB可改变PSCI小鼠的肠菌结构,降低PSCI小鼠肠杆菌科的丰度,增加其粪便丁酸盐水平,并逆转其相关病理改变。因此,补充NaB可能是一种潜在的PSCI治疗策略。
此研究还有一定的局限性。第一,招募的患者数量相对较少,还需要更多的样本进一步来证实这一结果。第二,尽管作者认为肠道来源的LPS在PSCI的发病机制中起着关键作用,但有必要使用TLR4基因敲除小鼠来证实其潜在的机制。第三,因为作者使用了整个粪便内容物,故不能排除其他病原体对PSCI的影响,也不能排除来自NaB的Na+对肠道菌群的影响。第四,此研究仅使用了单一卒中模型,应使用不同的卒中模型进一步验证这些发现。
综上所述,本研究首次揭示了肠道菌群和PSCI之间存在的因果关系,并提示这可能是通过炎症相关代谢产物LPS和丁酸盐介导的,为预防和治疗阿尔茨海默病等神经退行性疾病提供了新的思路。
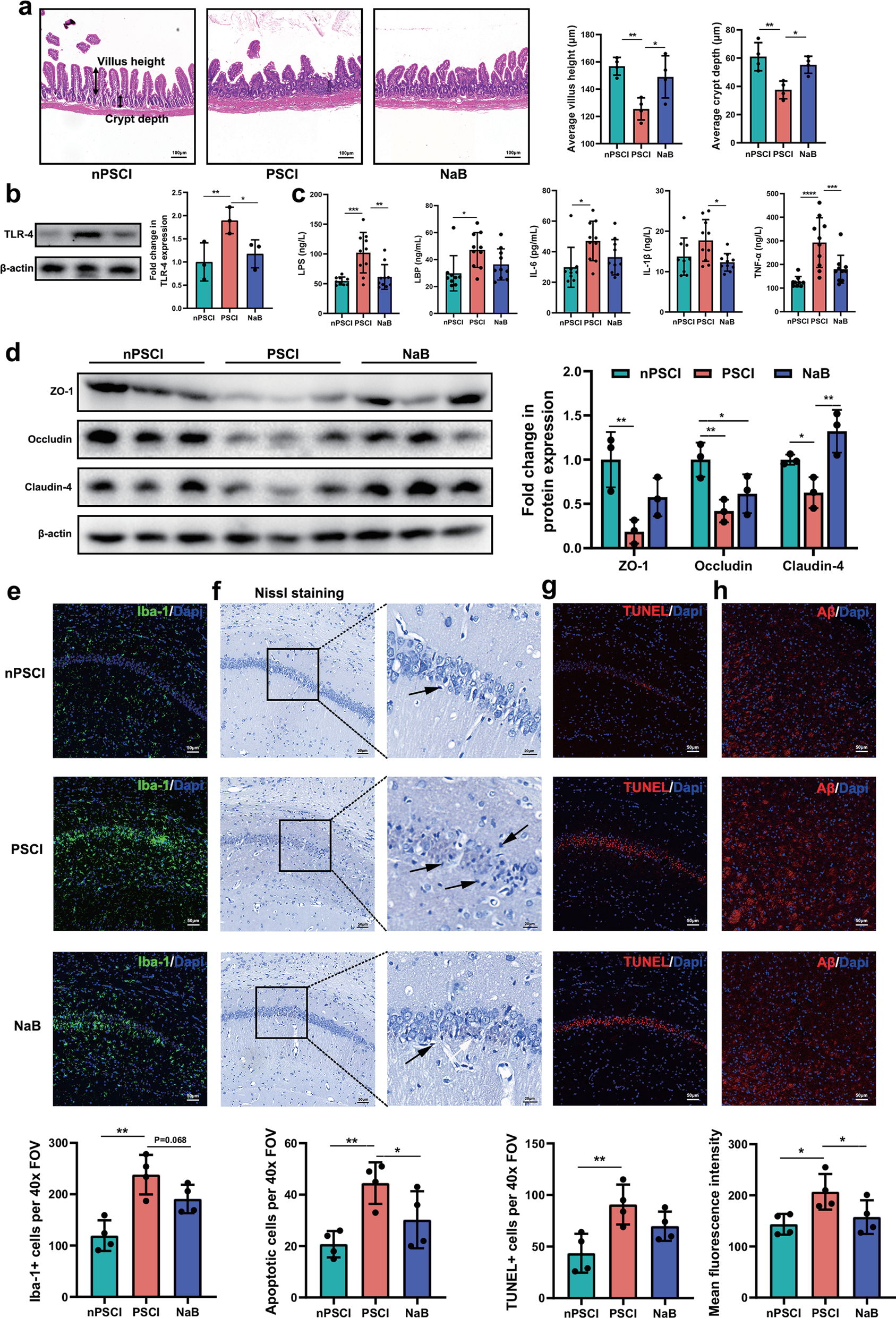
图1. PSCI相关的肠道菌群促进海马细胞凋亡和丘脑Aβ沉积。a使用H&E染色(比例尺= 100μm)评估回肠的形态,并分析平均绒毛高度和隐窝深度。b三组肠道TLR-4蛋白的表达。c外周血中LPS,LBP,IL-6,IL-1β和TNF-α的水平。d脑紧密连接蛋白ZO-1,Ocludin和Claudin-4在三组中的表达。E Iba-1(小胶质细胞标记物)双免疫染色和f Nissl染色 g 海马CA1区TUNEL染色检测凋亡神经元和h 丘脑Aβ染色(比例尺=50μm)。细胞计数40×视野 (FOV)。数据以平均±SEM表示,每组n=10-12只小鼠,单向方差分析,*P<0.05,**P<0.01,***P<0.001,****P<0.0001。

图2. PSCI相关的肠道菌群促进海马区细胞凋亡和丘脑Aβ沉积。PSCI患者肠道菌群的特点是肠杆菌科丰度增加,丁酸盐水平下降,导致肠道屏障破坏。LPS不断地通过渗漏的肠道进入循环,导致外周慢性炎症,持续的炎症破坏了血脑屏障的完整性,导致外周LPS和炎性细胞因子的不断渗透,诱导了调节认知功能的关键脑区—海马CA1区的神经元凋亡。此外,Aβ斑块是一种与认知障碍有关的有毒化学物质,大脑中的慢性低度炎症促进了丘脑中Aβ斑块的沉积。