肠道菌群组成与AD病理相关
Gut Microbiota Composition Is Related to AD Pathology
肠道菌群组成与AD病理相关
摘要译文
引言:多项研究报告了阿尔茨海默病(Alzheimer’s disease, AD)患者肠道菌群组成的改变。然而,在不同研究中观察到的差异并不一致。本研究目的是利用机器学习模型探讨AD、轻度认知功能损害(mild cognitive impairment, MCI)和主观认知功能减退(subjective cognitive decline, SCD)患者的肠道菌群组成与AD生物标志物之间的关系。
材料和方法:本研究纳入了阿姆斯特丹痴呆症队列研究(the Amsterdam Dementia Cohort)的170例患者,包括33例AD患者 [66±8岁,女性46%,简易精神状况检查(mini-mental state examination, MMSE)评分为21(19-24) ]、21例MCI患者(64±8岁,女性43%,MMSE评分为27(25-29) ]和116例SCD患者 [62±8岁,女性44%,MMSE评分29(28-30) ]。采集粪便样本,以16S rRNA测序法检测肠道菌群的组成。AD生物标志物包括脑脊液(cerebrospinal fluid, CSF)淀粉样蛋白-β 1-42(amyloid)和磷酸化tau蛋白(p-tau),以及MRI视觉评分(内侧颞叶萎缩、全脑皮质萎缩、白质高信号)。使用机器学习分类模型评估肠道菌群的组成和基于二分法的AD生物标志物之间的关联。调整年龄、性别、BMI、糖尿病、药物的使用和MMSE后,选择曲线下面积(area under the curve, AUC)最高的两个模型进行Logistic回归分析,以评估20种预测能力最优的菌群与机器学习模型的结局指标之间的关联。
结果:当AUC分别为0.64和0.63时,机器学习预测源于菌群组成的淀粉样蛋白和p-tau表现最好。排名最高的微生物包括几种产生短链脂肪酸(short chain fatty acid, SCFA)的菌属。本研究发现,柔嫩梭菌(C.leptum)丰度增高和凸腹真杆菌(E.ventriosum)、毛螺菌(Lachnospiraceae)、马文布赖恩特氏菌(Marvinbryantia)、单球菌(Monoglobus)、瘤胃球菌(R.torques)、罗氏菌(R.hominis)和克里斯滕森菌(C.R-7)丰度降低,与淀粉样变阳性几率升高相关;而毛螺菌、拉氏梭菌(Lachnoclostridium)、罗氏菌和沃氏嗜胆菌(B.wadsworthia)丰度降低与p-tau阳性几率升高相关。
结论:肠道菌群组成与淀粉样蛋白和p-tau阳性相关。本研究拓展了最近观察到的SCFA水平和AD患者CSF生物标志物关联的认识,结果表明产生SCFA的微生物丰度降低与淀粉样蛋白及p-tau阳性状态几率升高相关。
解读人 岳玲 教授
上海交通大学医学院附属精神卫生中心老年精神科 副主任医师、博士、硕士生导师
中国药理学会抗衰老与老年痴呆专业委员会青年常务委员、阿尔茨海默病防治协会临床专业分会常务委员
主持承担科技部脑计划青年科学家项目、国家自然科学基金、上海市卫生局等10余项科研课题

文献解读
2022年1月,荷兰阿姆斯特丹大学医学中心(UMC)学者Barbara J. H. Verhaar在Frontiers in Immunology发表了一篇题为“Gut Microbiota Composition Is Related to AD Pathology”(肠道菌群组成与AD病理有关)的研究。
阿尔茨海默病(AD)是痴呆最常见的病因,其特征是β淀粉样蛋白的沉积和神经纤维缠结的形成。也有研究认为AD是慢性神经炎症。而肠道菌群已被证明可以通过释放细菌毒素产生代谢物,并与免疫系统相互作用,从而产生神经炎症改变。从既往的动物研究来看,AD小鼠和野生型小鼠的肠道菌群的确存在差异,已有研究表明AD小鼠产生短链脂肪酸(SCFAs)的菌群减少。而将野生型小鼠的肠道菌群移植到AD小鼠模型上,可导致淀粉样蛋白减少,提示肠道菌群与AD之间可能存在因果关系。肠道菌群组成与AD病理学之间的相关性研究为未来的治疗提供可能的机会。基于调节肠道菌群组成的不同治疗策略已在其他疾病中进行了研究证实。
本研究收集了阿姆斯特丹痴呆队列中的170例患者,包括33例AD,21例轻度认知缺损(MCI)和116例主观认知下降(SCD)老人,通过机器学习的方法,比较肠道菌群组成与AD生物标志物之间的关系。该研究采用的AD标志物包括脑脊液淀粉样蛋白β1-42、p-tau水平,头颅MRI的脑白质高信号(WMH)、内侧颞叶萎缩(MTA)和全脑皮层萎缩(GCA)的评分,以及是否存在微出血。三个诊断组的肠道菌群在属水平上只有只有Subdoligranulum (p<0.05)和Phascolarctobacterium (p<0.05)两个属在组间丰度不同。两组的β多样性(PERMANOVA p=0.223)和α多样性(以Shannon指数、丰度和Faith的系统发育多样性)均无差异。(图1)。通过肠道菌群组成预测淀粉样蛋白状态的机器学习模型表现最佳,AUC 为 0.64±0.10(图 2),其次是p-tau模型,AUC为0.63±0.09。
研究进一步分析了预测脑脊液淀粉样蛋白的菌群,发现排名最高的预测因子主要是来自以产生SCFA而闻名的革兰氏阳性厚壁菌门的物种。SCFAs,包括乙酸盐,丙酸盐和丁酸盐,是肠道菌群的关键代谢物,由肠道细菌在其他难以消化的膳食纤维的发酵过程中产生,并具有免疫调节潜力功能。既往研究证实SCFAs可以通过诱导外周炎症或改变血脑屏障的完整性来间接影响AD的病理改变。另外,也有体外研究报告SCFA可能对小胶质细胞有直接的抗炎症作用。
该研究的优势在于:收集了处于AD疾病连续体不同阶段的患者,评估了包括CSF和MRI在内的数据,在样本收集上使用标准化方案,排除了服用抗生素的受试者,并通过16S基因扩增子测序测定菌群组成,这是一种广泛使用的测序方法。另外,结合机器学习预测模型的方法使我们能够找到最佳的预测微生物,嵌套交叉验证确保了模型的稳健性,并防止了过度拟合。
综上,本研究通过记忆门诊队列中发现了肠道菌群组成与AD病理学之间的关联。低丰度的产SCFA的微生物与AD病理学的几率较高有关。已知SCFAs具有外周免疫调节潜力,为治疗提供了推定的靶点。

图1 不同诊断组之间菌群组成特征的差异。(A)排名前20的菌群属组成图,以条形图表示诊断组:阿尔茨海默病痴呆(AD)、轻度认知障碍(MCI)和主观认知下降(SCD)。“Unknown”是指菌群分类学在属级上尚不清楚的ASV。以粗体标记各组间丰度不同的属(Kruskal-Wallis检验,p<0.05)。(B)每个诊断组的Bray-Curtis距离的主坐标分析(PCoA)图,采用PERMANOVA检验进行组间差异。(C) 每个诊断组肠道菌群组成的α多样性(Shannon指数)。
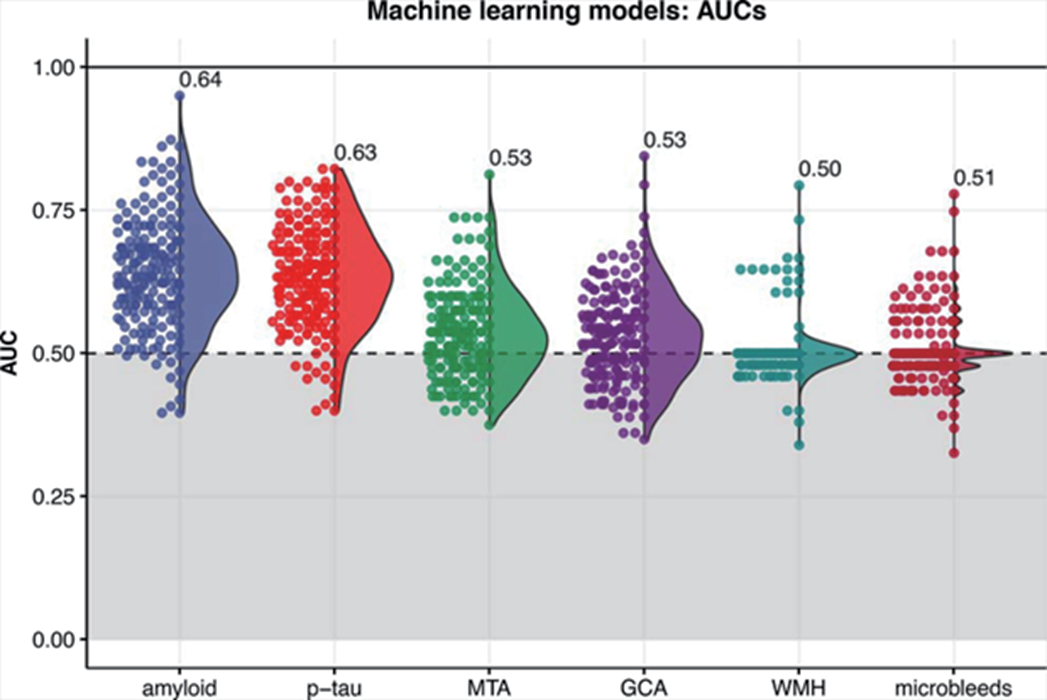
图2 机器学习分类模型(XGBoost算法)迭代产生的AUC曲线下的面积分布。标签显示的是200次迭代的平均AUC。MTA,内侧颞萎缩;GCA,全脑皮层萎缩;WMH,脑白质高信号。