一项甘露特钠治疗轻中度阿尔茨海默病为期36周的多中心、随机、双盲、安慰剂平行对照Ⅲ期临床试验
译文摘要:
背景:阿尔茨海默病(AD)迫切需要新的治疗方法。甘露特钠(GV-971)是一种海洋来源的寡糖,具有全新的作用机制。GV-971首个Ⅲ期临床试验已在中国完成。
方法:我们在轻至中度AD受试者中进行了一项Ⅲ期、双盲、安慰剂对照试验,评估GV-971的疗效和安全性。受试者随机接受安慰剂或GV-971(900mg)治疗36周。主要终点为药物-安慰剂在阿尔茨海默病评定量表-12项认知分量表(ADAS-cog12)自基线变化的差异。次要终点是药物-安慰剂在临床医生访视的印象改变量表(CIBIC+)、阿尔茨海默病合作研究-日常生活活动能力量表(ADCS-ADL)和神经精神症状量表(NPI)上的差异,并对安全性和耐受性进行监测。
结果:共818例受试者进行随机化分组:408例受试者接受GV-971治疗,410例受试者接受安慰剂治疗。GV-971组的ADAS-Cog12在每个测量时间点上均显著优于安慰剂组,药物-安慰剂差异具有统计学意义,从第4周访视中即可观察到,并在整个试验中持续存在。治疗36周后,两组之间自基线的变化差异为-2.15分(95%置信区间,-3.07至-1.23;P<0.0001;效应值0.531)。治疗后出现的不良事件发生率在GV-971组与安慰剂组相当(73.9%,75.4%)
结论:在这项为期36周试验的研究中,GV-971能够在整个观察期内显著并且持续改善认知功能,安全性和耐受性良好。
试验注册:ClinicalTrials.gov,NCT02293915。2014年11月19日注册
关键词:甘露特钠,疗效,安全性,阿尔茨海默病,临床试验
原文链接:https://alzres.biomedcentral.com/articles/10.1186/s13195-021-00795-7
Xiao S, Chan P, Wang T, et al. Alzheimers Res Ther.2021, Mar 17;13(1):62.
研究解读:
2021年3月,上海市精神卫生中心肖世富教授、北京协和医院张振馨教授及上海药物研究所耿美玉教授共同通讯在国际知名期刊Alzheimer's Research & Therapy(《阿尔茨海默病研究与治疗》)上发布了一项Ⅲ期临床试验,评估甘露特钠(GV-971)对轻-中度AD患者的疗效及安全性。此前,该研究团队已经在中国进行了Ⅱ期临床试验,证实GV-971是安全且耐受性良好,并确定了Ⅲ期临床的给药剂量为900mg/天。本项的Ⅲ期临床试验证实GV-971 900mg可以显著改善轻-中度AD患者的认知功能。该Ⅲ期临床试验纳入50-85岁的轻度至中度AD受试者,随机分配(比例为1:1)接受36周的GV-971(450 mg,每日2次)或安慰剂治疗。主要研究终点为基线至终点的ADAS-Cog12评分变化,次要终点为安全性结局(不良事件,实验室评估,生命体征等)。从研究结果中可以看出,自第4周开始,GV-971组的认知功能明显优于安慰剂组,并且持续至第36周(如图所示)。在安全性结局方面,两组的不良事件发生率相似(如表所示)。
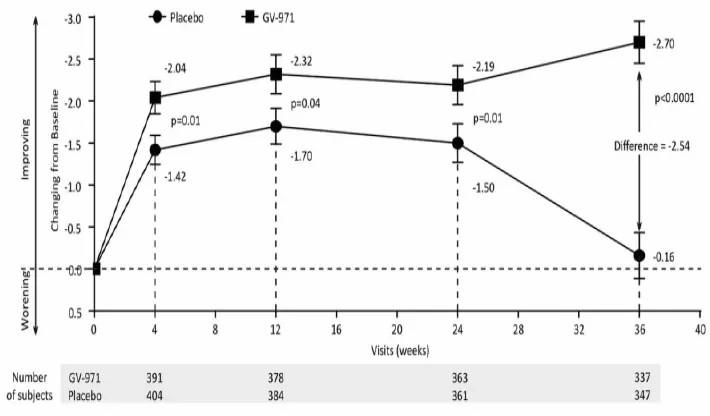
(图据Alzheimer's Research & Therapy)
图:ADAS-Cog12平均评分在第4周、第12周、第24周和第36周与基线相比发生的变化(观察值)
图解:ADAS-Cog12评分(分数范围从0到75分,分数越高表示损伤越大)从基线到第36周的平均变化通过完整分析显示出来。误差条表示标准误差(SE)。p值由Wilcoxon秩和检验得到。
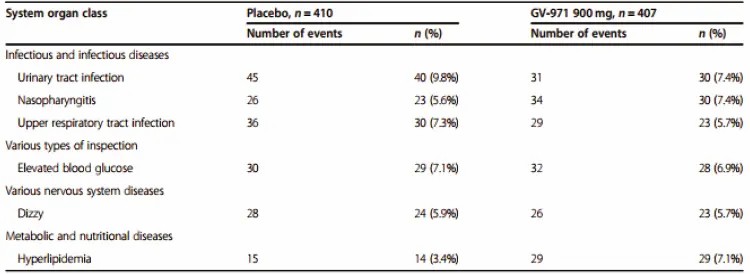
表:研究中≥5%的受试者出现的TEA
注:TEAE, treatment-emergent adverse event:治疗期间发生的不良事件。TEAE定义为无论与药物研究的关系如何,在第一次双盲研究药物给药时或之后,直到最后一次双盲研究药物给药后28天或V6之前受试者退出的提前终止日期之间发生的任何不良事件。(表据Alzheimer's Research & Therapy)
非临床研究中已经证实GV-971可以通过调控肠-脑轴及减轻外周炎症来减少神经炎症,同时还可以直接与β-淀粉样蛋白(amyloid β-protein,Aβ)结合,从而减少Aβ在大脑中沉积。此次的Ⅲ期临床试验证实了该药的疗效及安全性,评价获益与风险关系,最终为药物上市申请的审查提供充分的依据。从治疗后第4周开始,GV-971就可以显著改善AD患者的认知功能,且持续至研究终点36周。同时,与安慰剂组相比,不良事件的发生率并没有显著差异。由于该药的II期、Ⅲ期临床试验均在中国进行,尚不明确在其他人群中的疗效及安全性。因此,申办方目前正在进行全球多中心的Ⅲ期临床试验,研究设计将双盲试验周期从9个月延长到了12个月,随后有6个月的开放期,共计长达18个月的疗效及安全性观察,同时将生物标志物(包括肠道菌群、肠道代谢物、AD生物标志物、炎症细胞等)探索性指标纳入研究,GV-971的脑肠轴作用机制有望得到进一步验证。据悉,目前GV-971国际多中心临床试验申请已获得美国食品药品监督管理局(FDA)、加拿大、法国、中国大陆等9个国家/地区药品管理局的批准,已于2021年2月3日完成首例患者给药。
之前,在临床上仅有两种类型的药物可用于改善AD患者的认知功能,且均为递质类药物,无法改变疾病进展,选择十分有限。而该项临床研究证实了甘露特钠胶囊(GV-971)作为一种全新机制的药物,可以显著改善轻-中度AD患者的认知功能,潜在改变疾病进程,同时安全性及耐受性良好。近年来,科学家也开始关注肠道菌群在AD的发生、发展过程中发挥着重要作用;领域内出现新的证据支持肠道菌群失调、神经炎症、Aβ沉积和tau磷酸化的相互作用,会加快AD进展。非临床研究表明,GV-971对肠道菌群失调,神经炎症和Aβ沉积的治疗作用能够改善病理级联反应,以达到改善症状和潜在延缓疾病进展的作用,为患者带来长期获益。目前,该药物已于2019年底在国内上市,为AD的治疗提供了新的选择;同时,也为该领域的基础研究和新药研发带来新的思路。






